
【题目】下列分离物质的方法中,根据微粒大小进行分离的是( )
A. 分液 B. 过滤 C. 分馏 D. 重结晶
科目:高中化学 来源: 题型:
【题目】甲苯是由苯环和甲基结合而成的,甲苯能使酸性高锰酸钾溶液褪色,这是因为( )
A. 烷烃能使酸性高锰酸钾溶液褪色
B. 苯环能使酸性高锰酸钾溶液褪色
C. 甲基使苯环的活性增强
D. 苯环使甲基的活性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)可逆反应:N2O4![]() 2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是 (选填序号)
2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是 (选填序号)
①单位时间内生成2nmolNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 ml的密闭容器中,发生反应:
N2O4![]() 2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算: (本小题要求写出解过程)
2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算: (本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率;
②达到平衡时体系的压强与开始时体系的压强之比;
③达到平衡时,体系中NO2的物质的量浓度;
④N2O4的平衡转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2(g)+1/2O2(g)![]() SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1.请回答下列问题:
SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1.请回答下列问题:
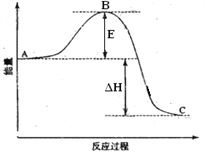
(1)图中可知A、C分别表示______________、_______________;E的大小对该反应的反应热有无影响?___________。
(2)图中△H=______________;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成5molSO3(g)的△H=______kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.6.02×1023个SO2分子的质量为64g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中一定能判断某化学平衡发生移动的是( )
A. 混合物中各组分的浓度改变 B. 正、逆反应速率改变
C. 混合物中各组分的含量改变 D. 反应物的转化率改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳顺序是
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A. ①② B. ③② C. ②①③ D. ③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第五套人民币中的1元硬币的材质为钢芯镀镍合金。下列关于1元硬币的说法中不正确的是
A. 有一定硬度,耐磨损;但硬度不是很大,否则文字和图案很难压印上去
B. 化学性质稳定,抗腐蚀
C. 每枚硬币实际价值远远高于面值1元
D. 每枚硬币实际价值低于面值1元
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。

(1)汽车尾气中NO生成过程的能量变化示意图如图。该条件下,1molN2和1molO2完全反应生成NO会_______________(填“吸收”或“放出”)___________kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子流动方向是从_________电极流向_______电极(填“NiO”或“Pt”).
③Pt电极上的电极反应式为_______________________________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请表中数据补充完整:a___________;b____________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com