
【题目】硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜。
已知:2NO2+2NaOH=NaNO3+ NaNO2+H2O ,NO+NO2+2NaOH=2NaNO2+H2O(以下涉及到的气体体积均为标准状况下数据):
(1)甲组用a克Cu粉,在加热的条件下,与空气充分反应,然后将生成的CuO全部溶于VmL稀硝酸中,制得硝酸铜溶液,则所需稀硝酸的浓度至少为_______mol/L,需要质量分数为ω%,密度为ρg/cm3的浓硝酸_______mL(均用最简分式表示)。
(2)乙组用b克Cu粉,全部溶于过量的稀硝酸中,溶液质量增重_____克,将生成的气体通入足量NaOH溶液中并同时通入氧气的体积至少_______L才能使生成的气体吸收完全(均用最简分式表示)。
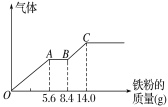
(3)丙组取某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。列式计算原混合酸中硝酸的物质的量是多少?____________硫酸的物质的量浓度多少?_________
【答案】![]()
![]()
![]()
![]() H2SO4浓度为2.5 mol/L HNO3物质的量为0.2 mol
H2SO4浓度为2.5 mol/L HNO3物质的量为0.2 mol
【解析】
(1)由Cu原子、硝酸根离子守恒可知n(HNO3)=2n[Cu(NO3)2]=2n(Cu),再根据c=![]() 计算硝酸浓度;根据c=
计算硝酸浓度;根据c=![]() 计算浓硝酸的物质的量浓度,再根据V=
计算浓硝酸的物质的量浓度,再根据V=![]() 计算需要浓硫酸体积;
计算需要浓硫酸体积;
(2)发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据差量法计算溶液质量增重;根据电子转移守恒计算生成NO的物质的量,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,计算NO2的物质的量,结合2NO+O2=2NO2计算需要通入氧气;
(3)由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑;根据OA段离子方程式计算原混合酸中NO3-物质的量,与混合溶液中硝酸为每一份中的2倍;最终消耗Fe为14g,此时溶液中溶质为 FeSO4,则n(FeSO4)=n(Fe),由硫酸根守恒n(H2SO4)=n(FeSO4),再根据c=![]() 计算c(H2SO4)。
计算c(H2SO4)。
(1)由Cu原子、硝酸根离子守恒可知n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×![]() =
=![]() mol,则硝酸浓度为
mol,则硝酸浓度为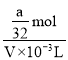 =
=![]() mol/L;根据c=
mol/L;根据c=![]() 可知,浓硝酸的物质的量浓度为
可知,浓硝酸的物质的量浓度为![]() mol/L=
mol/L=![]() mol/L,需要浓硝酸的体积为
mol/L,需要浓硝酸的体积为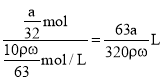 =
=![]() mL;
mL;
(2)设溶液质量增重为m,则:
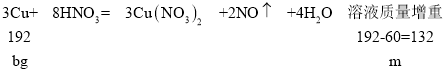
所以![]() ,解得:m=
,解得:m=![]() g=
g=![]() g,Cu的物质的量为
g,Cu的物质的量为![]() =
=![]() mol,根据电子转移守恒,生成NO物质的量为
mol,根据电子转移守恒,生成NO物质的量为![]() mol×
mol×![]() =
=![]() mol,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,则NO2的物质的量为
mol,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,则NO2的物质的量为![]() mol×
mol×![]() =
=![]() mol,由2NO+O2=2NO2可知,需要通入氧气为
mol,由2NO+O2=2NO2可知,需要通入氧气为![]() mol×
mol×![]() ×22.4L/mol=
×22.4L/mol=![]() L;
L;
(3)由图象可知,由于铁过量,OA段发生反应为:Fe+NO3+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑。OA段发生反应为:Fe+NO3+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,OA段消耗Fe为5.6g,所以n(NO3)=n(Fe)=![]() =0.1mol,原混合物中硝酸物质的量为0.1mol×2=0.2mol;最终消耗Fe为14g,此时溶液中溶质为FeSO4,则n(FeSO4)=n(Fe)=
=0.1mol,原混合物中硝酸物质的量为0.1mol×2=0.2mol;最终消耗Fe为14g,此时溶液中溶质为FeSO4,则n(FeSO4)=n(Fe)=![]() =0.25mol,由硫酸根守恒n(H2SO4)=n(FeSO4)=0.25mol,则c(H2SO4)=
=0.25mol,由硫酸根守恒n(H2SO4)=n(FeSO4)=0.25mol,则c(H2SO4)=![]() =2.5mol/L。
=2.5mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )
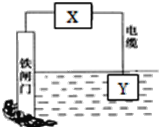
A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含着丰富的矿物质。从海水中提取镁的主要过程如下:

![]()
(1)过程Ⅱ中,Mg2+转化为Mg(OH)2沉淀的离子方程式是___。
(2)过程Ⅱ中,分离得到Mg(OH)2沉淀的实验操作名称是___。
(3)下列说法中,正确的是___。
a.过程Ⅰ发生的是物理变化
b.过程Ⅲ中主要发生分解反应
c.过程Ⅳ可以通过电解得到镁
d.过程Ⅰ~Ⅲ的目的是富集、提纯MgCl2
(4)理论上生产24kgMg,需要消耗MgCl2的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
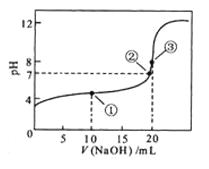
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图。
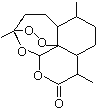
(1)青蒿素的分子式为________________________。
(2)为了引入过氧基![]() ,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
①取代 ②加成 ③消去 ④酯化 ⑤还原
(3)天然香草醛(![]() )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
![]()
(4)步骤①③的作用是_________________________________________________________________________________。
(5)C8H10O3的结构简式:__________________________________________________________。
(6)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的一种结构简式_________________。
①有苯环;②能水解;③能发生银镜反应;④遇FeCl3溶液发生显色反应。
(7)苄基乙醛![]() 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
已知:羰基α-H可发生反应:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的相对原子质量为34.969,下列相关说法正确的是( )
的相对原子质量为34.969,下列相关说法正确的是( )
A.氯元素的近似相对原子质量为35
B.氯元素的某种同位素的质量数为35
C.氯元素的中子数为18
D.氯原子的质量为34.969
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Inorganic Syntheses》(无机合成)一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。

该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅是中学常见元素,其单质及化合物有独特的性质和用途。回答问题:
(1)基态碳原子的电子排布图为___,CO2属于___分子(选填“极性”或“非极性”);
(2)60克SiO2晶体中含有的Si-O键数目为___(用NA表示);
(3)有机物M( )中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
)中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
(4)碳元素能形成多种单质如金刚石、石墨、C60等,回答下列问题:
(Ⅰ)C60的晶体类型是__晶体。
(Ⅱ)石墨是一种混合晶型,结构中具有的作用力有___。
a.共价键 b.分子间作用力 c.氢键 d.金属键 e.离子键
(Ⅲ)金刚石晶胞结构如图所示,假设金刚石晶胞的边长为a cm,阿伏伽德罗常数为NA,则金刚石的密度可以表示为___g/cm3。
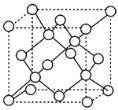
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com