
����Ŀ����ˮ���̺��ŷḻ�Ŀ����ʡ��Ӻ�ˮ����ȡþ����Ҫ�������£�

![]()
��1�����̢��У�Mg2+ת��ΪMg(OH)2���������ӷ���ʽ��___��
��2�����̢��У�����õ�Mg(OH)2������ʵ�����������___��
��3������˵���У���ȷ����___��
a.���̢������������仯
b.���̢�����Ҫ�����ֽⷴӦ
c.���̢�����ͨ�����õ�þ
d.���̢��Ŀ���Ǹ������ᴿMgCl2
��4������������24kgMg����Ҫ����MgCl2�����ʵ�����___mol��
���𰸡�![]() ���� acd 1000
���� acd 1000
��������
���⼴��ˮ����þ��ʵ�飬��ˮ��![]() Ũ�Ƚϵͣ����Ҫ����I��Ũ������
Ũ�Ƚϵͣ����Ҫ����I��Ũ������![]() ��������ͨ��ʯ���飬��
��������ͨ��ʯ���飬��![]() ����ˮ�е�
����ˮ�е�![]() �������������˺�õ�
�������������˺�õ�![]() ���ټ�����õ�
���ټ�����õ�![]() �����õ���ˮ
�����õ���ˮ![]() �ٵ�⣬���ɵõ�����þ���ݴ����������ɡ�
�ٵ�⣬���ɵõ�����þ���ݴ����������ɡ�
��1�������صķ�Ӧʵ��������![]() ȥ�Ƹ����ܵ�
ȥ�Ƹ����ܵ�![]() �����
�����![]() Ҫд��ѧʽ�����ӷ���Ϊ
Ҫд��ѧʽ�����ӷ���Ϊ![]() ��
��
��2����ȻҪ�����������Һ�з����������ô���˼��ɣ�
��3��a.����I��Ũ��������Ϊ�����仯��a����ȷ��
b.����IIIʵ������![]() �����ᷴӦת��Ϊ
�����ᷴӦת��Ϊ![]() �Ĺ��̣���ȻΪ���ֽⷴӦ��b�����
�Ĺ��̣���ȻΪ���ֽⷴӦ��b�����
c.��ˮ![]() ���Ե��õ�����þ��������c����ȷ��
���Ե��õ�����þ��������c����ȷ��
d.����I������III����Ϊ�˽���ˮ�е�![]() �������ᴿ���������ǽ��е�⣬d����ȷ��
�������ᴿ���������ǽ��е�⣬d����ȷ��
��ѡacd��
��4������þԪ���غ㣬��ȻҪ�õ�![]() ��þ����������Ȼ��Ҫ1000mol��
��þ����������Ȼ��Ҫ1000mol��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�������ȡ���һ�ֹ�ҵ�����������£�

����˵���д������
A.���裨1����Ҫ����װ��
B.���裨2����Ҫ�õ���Һ©��
C.�����Ŀ�����ÿ������л����γɳ���
D.������������I-ת��ΪI2������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���

��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������������������Ҫװ����ͼ��A��ʾ����Ҫ�������a�Թ��а�2��3��2�����������Ũ���ᡢ�Ҵ�������Ļ����ڰ�Aͼ����װ�ã�ʹ����������������ͨ��b�Թ���ʢ�ı���̼������Һ�����뼸�η�̪��Һ���У���С�����a�Թ��еĻ��Һ���ܵ�b�Թ����ռ���Լ2mL����ʱֹͣ���ȣ�����b�Թܲ�������Ȼ���ô�����Һ��ֲ㣻�ݷ��������������������
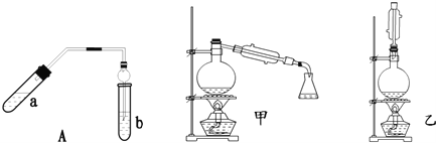
��ش��������⣺
��1��������У�������һ�����Ļ��Һ����ȷ������__��
��2����ʵ�����ú�18O���Ҵ����������ã��÷�Ӧ�û�ѧ����ʽ�ǣ�__��
��3��������У�Ҫ��С����ȣ���ԭ����__��
��4��������пɹ۲쵽b�Թ�����ϸС������ð����д���÷�Ӧ�����ӷ���ʽ��__��
��5��Aװ����ʹ�����ιܳ������������⣬��һ��Ҫ������__��������з���������������ʹ�õ�һ��������__��
��6��Ϊ������÷�Ӧ��ס�����λͬѧ�ֱ������ͼ�мס�������װ�ã���ͬѧ����Ӧ�����ȴ�����ñ���̼������Һ��ȡ��ƿ�еIJ��������Ϊ��������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(M)�dz��õ���������ʹҩ����ϳ�·�����£�
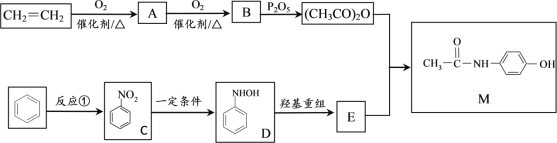
���������գ�
(1)A�Ľṹ��ʽΪ____________��C��D�ķ�Ӧ����Ϊ___________________��
(2)ʵ�����н��з�Ӧ�ٵ�ʵ��ʱ�����Լ���˳��Ϊ________________________��
(3)�����й�E��˵����ȷ����____________����ѡ���ţ�
a������ʽΪC6H6NO b��������ˮ�����ӳɷ�Ӧ
c������FeCl3��Һ�ܷ�����ɫ��Ӧ d�����ܺ�����������Һ��Ӧ�����ܺ����ᷴӦ
(4)��֪![]() ��
��![]() ���������ƣ�д��һ��������M��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��______________________
���������ƣ�д��һ��������M��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��______________________
(5)��������������M��ͬ���칹����_____________�֡�
�ٱ�����ֻ�����ֲ�ͬ��������ԭ�ӣ��ڱ��������У�NH2���������������ʡ�
(6)N-�ڱ��������ʰ���( )����Ҫ�Ļ����м��壬��ҵ�����ڶ��ױ��ʰ���(NH2-CH2-COOH)Ϊԭ��ͨ��һϵ�еķ�Ӧ��ȡ�û����������������̵������Ϣ��д�����һ����Ӧ�Ļ�ѧ����ʽ��_____________________
)����Ҫ�Ļ����м��壬��ҵ�����ڶ��ױ��ʰ���(NH2-CH2-COOH)Ϊԭ��ͨ��һϵ�еķ�Ӧ��ȡ�û����������������̵������Ϣ��д�����һ����Ӧ�Ļ�ѧ����ʽ��_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����������ԭ��Ӧ����(����)
A. S��O 2 ![]() SO2
SO2
B. Fe(OH)3��3HCl===FeCl3��3H2O
C. 2Mg��CO2![]() 2MgO��C
2MgO��C
D. 4HNO3(Ũ)![]() 4NO2����O2����2H2O
4NO2����O2����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һδ֪����ɫ��Һ��ֻ���ܺ������������е�������(������ˮ���������H+��OH��)��H+��NH4+��K+��Mg2+��Cu2+��Al3+��NO3����CO32������ȡ����εμ�NaOH��Һ����ó�����NaOH��Һ�������ϵ��ͼ�������Ʋ�������
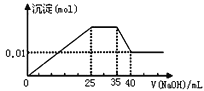
A.ԭ��Һһ��������H+��Cu2+��CO32��
B.����ȷ��ԭ��Һ�Ƿ���K����NO3��
C.ԭ��Һ��n(Mg2+):n(Al3+):n(NH4+)��1��1��2
D.ʵ�����ӵ�NaOH��ҺŨ��Ϊ2mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ����Ҫ�Ļ���ԭ�ϣ��������ַ������ɵõ�����ͭ��
��֪��2NO2+2NaOH=NaNO3+ NaNO2+H2O ��NO+NO2+2NaOH=2NaNO2+H2O�������漰�������������Ϊ��״�������ݣ���
(1)������a��Cu�ۣ��ڼ��ȵ������£��������ַ�Ӧ��Ȼ�����ɵ�CuOȫ������VmLϡ�����У��Ƶ�����ͭ��Һ��������ϡ�����Ũ������Ϊ_______mol/L����Ҫ��������Ϊ��%���ܶ�Ϊ��g/cm3��Ũ����_______mL����������ʽ��ʾ����
(2)������b��Cu�ۣ�ȫ�����ڹ�����ϡ�����У���Һ��������_____�ˣ������ɵ�����ͨ������NaOH��Һ�в�ͬʱͨ���������������_______L����ʹ���ɵ�����������ȫ����������ʽ��ʾ����
(3)����ȡijϡ�����ϡ����Ļ����Һ200 mL��ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�9.6 g������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ(��֪����ֻ����ԭΪNO����)����ʽ����ԭ���������������ʵ����Ƕ��٣�____________��������ʵ���Ũ�ȶ��٣�_________
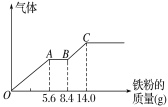
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʽ������ͬ����
A. ![]() B. HCOOCH3��HOOCCH3
B. HCOOCH3��HOOCCH3
C.  D. -NO2��NO2
D. -NO2��NO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com