
【题目】对乙酰氨苯酚(M)是常用的消炎解热镇痛药。其合成路线如下:
完成下列填空:
(1)A的结构简式为____________。C→D的反应类型为___________________。
(2)实验室中进行反应①的实验时添加试剂的顺序为________________________。
(3)下列有关E的说法正确的是____________。(选填编号)
a.分子式为C6H6NO b.能与溴水发生加成反应
c.遇到FeCl3溶液能发生显色反应 d.既能和氢氧化钠溶液反应,又能和盐酸反应
(4)已知![]() 与
与![]() 的性质相似,写出一定条件下M与NaOH溶液反应的化学方程式。______________________
的性质相似,写出一定条件下M与NaOH溶液反应的化学方程式。______________________
(5)满足下列条件的M的同分异构体有_____________种。
①苯环上只有两种不同环境的氢原子;②苯环上连有-NH2;③属于酯类物质。
(6)N-邻苯二甲酰甘氨酸( )是重要的化工中间体,工业上以邻二甲苯和甘氨酸(NH2-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式。_____________________
)是重要的化工中间体,工业上以邻二甲苯和甘氨酸(NH2-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式。_____________________
【答案】CH3CHO 还原反应 浓硝酸,浓硫酸,苯 cd ![]() +2NaOH
+2NaOH![]() CH3COONa+
CH3COONa+![]() +H2O 3
+H2O 3 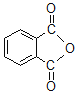 +NH2CH2COOH→
+NH2CH2COOH→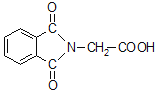 +H2O
+H2O
【解析】
B在五氧化二磷作用下得到乙酸酐,则B为CH3COOH,可推知乙烯与氧气反应生成A为CH3CHO,A进一步发生氧化反应生成乙酸,由M的结构可知,E为![]() ,反应①为苯与浓硝酸、浓硫酸发生硝化反应生成硝基苯,由C、D分子式可知,C分子发生加氢、去氧得到D;
,反应①为苯与浓硝酸、浓硫酸发生硝化反应生成硝基苯,由C、D分子式可知,C分子发生加氢、去氧得到D;
(4)M水解得到的乙酸与![]() ,乙酸与
,乙酸与![]() 中酚羟基与氢氧化钠继续反应;
中酚羟基与氢氧化钠继续反应;
(5)M的同分异构体满足:苯环上连有-NH2,属于酯类物质,苯环上只有两种不同环境的氢原子,同分异构体应含有2个不同取代基、且处于对位,另外取代基为CH3COO—或HCOOCH2—或CH3OOC—;
(6)由转化关系中E转化为M的反应可知, 与NH2CH2COOH反应得到
与NH2CH2COOH反应得到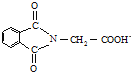 与水。
与水。
由上述分析可知:A为CH3CHO,B为CH3COOH,C为![]() ,D为
,D为![]() ,E为
,E为![]() ,M为
,M为![]() 。
。
(1)由上述分析可知,A的结构简式为:CH3CHO,C为![]() ,D为
,D为![]() ,C与HCl、Fe存在条件下发生加氢去氧的还原反应产生
,C与HCl、Fe存在条件下发生加氢去氧的还原反应产生![]() ,所以C→D的反应类型为还原反应;
,所以C→D的反应类型为还原反应;
(2)反应①为苯与浓硝酸、浓硫酸存在条件下加热发生取代反应产生硝基苯,实验时添加试剂的顺序为:先加入浓硝酸,再加入浓硫酸,待溶液恢复至室温后再加入苯;
(3)由上述分析可知,E为![]() 。
。
a.根据E的结构简式可知其分子式为C6H7NO,a错误;
b.E含有酚羟基,且酚羟基邻位含有氢原子,能与溴水发生取代反应,b错误;
c.E含有酚羟基,遇到FeCl3
d.E含有酚羟基,能与氢氧化钠溶液反应,含有氨基,能与盐酸反应,d正确,
故合理选项是cd;
(4)M为![]() ,M水解得到的乙酸与
,M水解得到的乙酸与![]() ,乙酸与
,乙酸与![]() 中酚羟基与氢氧化钠继续反应,反应方程式为:
中酚羟基与氢氧化钠继续反应,反应方程式为:![]() +2NaOH
+2NaOH![]() CH3COONa+
CH3COONa+![]() +H2O;
+H2O;
(5)M的同分异构体满足:苯环上连有—NH2,属于酯类物质,苯环上只有两种不同环境的氢原子,同分异构体应含有2个不同取代基、且处于对位,另外取代基为CH3COO—或HCOOCH2—或CH3OOC—,符合条件的同分异构体有3种;
(6)由转化关系中E转化为M的反应可知, 与NH2CH2COOH反应得到
与NH2CH2COOH反应得到 和水,故最后一步反应的化学方程式为:
和水,故最后一步反应的化学方程式为: +NH2CH2COOH→
+NH2CH2COOH→ +H2O。
+H2O。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
编号 | A | B | C | D |
实验 方案 |
置于光亮处 |
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
实验 目的 | 验证甲烷与氯气发生化学反应 | 进行喷泉实验 | 验证Fe电极被保护 | 验证乙炔的还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-、Cl-、NO3-中的几种,将此溶液分成两等份,进行如下实验:
①在一份溶液中加入足量NaOH,加热,可收集到标准状态下的气体1.12 L;
②在另一份溶液中加入足量Ba(NO3)2溶液,有白色沉淀产生,过滤得到沉淀2.33 g;
③在②的滤液中加入足量AgNO3溶液,又有4.7 g沉淀产生。
有关该溶液中离子种类(不考虑H+和OH-)的判断正确的是
A.溶液中至少有2种阳离子B.只能确定溶液中NH4+、SO42-是否存在
C.溶液中最多有4种阴离子D.溶液中不可能同时存在K+和NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硝酸钾用途广泛,工业上一般用复分解反应制取硝酸钾(相关物质的溶解度曲线见表)。以硝酸钠和氯化钾为原料制备硝酸钾的工艺流程如下:
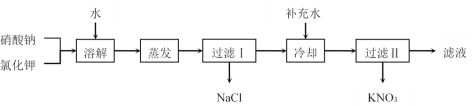

完成下列填空:
(1)为了加速固体溶解,可采取的措施有__________(至少写两种);实验室进行蒸发结晶操作时,为了防止液滴飞溅,进行的操作是_____________。
(2)过滤I所得滤液中含有的离子是________;过滤I所得滤液在进行冷却结晶前应补充少量水,目的是______________。
(3)检验产品KNO3中杂质的方法是________________。
II.实验室模拟工业上用氯化钾和硝酸铵为原料制取硝酸钾的过程如下:
取40 g NH4NO3和37.25 g KCl固体加入100 g水中,加热至90℃,固体溶解, 用冰水浴冷却至5℃以下,过滤(a)。在滤液中再加入NH4NO3,加热蒸发,当体积减小到约原来的![]() 时,保持70℃过滤(b),滤液可循环使用。完成下列填空:
时,保持70℃过滤(b),滤液可循环使用。完成下列填空:
(4)过滤(a)得到的固体物质主要是__________;在滤液中再加入NH4NO3的目的是________________________。
(5)为检测硝酸钾样品中铵盐含量,称取1.564 g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00 mL 0.102 mol/L H2SO4溶液全部吸收,滴定过量的H2SO4用去0.089 mol/L标准NaOH溶液16.55 mL。滴定过程中使用的指示剂是________;样品中含铵盐(以氯化铵计)的质量分数是___________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含着丰富的矿物质。从海水中提取镁的主要过程如下:

![]()
(1)过程Ⅱ中,Mg2+转化为Mg(OH)2沉淀的离子方程式是___。
(2)过程Ⅱ中,分离得到Mg(OH)2沉淀的实验操作名称是___。
(3)下列说法中,正确的是___。
a.过程Ⅰ发生的是物理变化
b.过程Ⅲ中主要发生分解反应
c.过程Ⅳ可以通过电解得到镁
d.过程Ⅰ~Ⅲ的目的是富集、提纯MgCl2
(4)理论上生产24kgMg,需要消耗MgCl2的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)单质化学性质最不活泼的是___;
(2)地壳中含量最多的元素是___(填名称);
(3)单质常用作半导体材料的是___;
(4)Mg原子结构示意图为___;
(5)O和S中,原子半径较大的是___;
(6)CH4和NH3中,热稳定性较强的是___(填名称);
(7)新制氯水有漂白作用,是因为其中含有___(填“HCl”或“HClO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),两性氢氧化物是___;
(9)某烃分子中含有6个碳原子,结构简式为![]() ,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图。
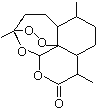
(1)青蒿素的分子式为________________________。
(2)为了引入过氧基![]() ,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
①取代 ②加成 ③消去 ④酯化 ⑤还原
(3)天然香草醛(![]() )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
![]()
(4)步骤①③的作用是_________________________________________________________________________________。
(5)C8H10O3的结构简式:__________________________________________________________。
(6)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的一种结构简式_________________。
①有苯环;②能水解;③能发生银镜反应;④遇FeCl3溶液发生显色反应。
(7)苄基乙醛![]() 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
已知:羰基α-H可发生反应:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组拟探究H+浓度对MnO2与H2O2反应速率的影响。现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间。
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
水的体积/mL | 15 | 14.5 | V4 | 13.5 |
所需时间t/s | t1 | t2 | t3 | t4 |
已知酸性条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(1)实验Ⅰ发生反应的化学方程式为__,实验Ⅱ中MnO2的作用是__。
(2)上表中V1=__mL,V3=___mL。
(3)若实验测得t2>t3>t4,则可得出的实验结论是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com