
����Ŀ��ij��Һ�п��ܺ���K����NH4����Ba2����SO42����I����Cl����NO3���еļ��֣�������Һ�ֳ����ȷݣ���������ʵ�飺
����һ����Һ�м�������NaOH�����ȣ����ռ�����״̬�µ�����1.12 L��
������һ����Һ�м�������Ba(NO3)2��Һ���а�ɫ�������������˵õ�����2.33 g��
���ڢڵ���Һ�м�������AgNO3��Һ������4.7 g����������
�йظ���Һ���������ࣨ������H����OH�������ж���ȷ����
A.��Һ��������2��������B.ֻ��ȷ����Һ��NH4����SO42���Ƿ����
C.��Һ�������4��������D.��Һ�в�����ͬʱ����K����NO3��
���𰸡�C
��������
����һ����Һ�м�������NaOH�����ȣ����ռ�����״̬�µ�����1.12 L������NaOH��Һ���Ȳ���������ֻ���ǰ�������һ������NH4+�������ʵ���Ϊn(NH3)=![]() =0.05 mol��
=0.05 mol��
������һ����Һ�м�������Ba(NO3)2��Һ���а�ɫ�������������˵õ�����2.33 g����һ������SO42-�������ʵ���Ϊn(SO42-)=n(BaSO4)=![]() =0.01 mol��Ba2+��SO42-�ᷢ�����ӷ�Ӧ���ܴ������棬����SO42-����һ��������Ba2+��
=0.01 mol��Ba2+��SO42-�ᷢ�����ӷ�Ӧ���ܴ������棬����SO42-����һ��������Ba2+��
���ڢڵ���Һ�м�������AgNO3��Һ������4.7 g�����������˳���δ˵����ɫ���ʿ���ΪAgCl��AgI����I-��Cl-�����ʵ���֮����0.05-0.01��2=0.03 mol��
A. ���ݷ�����֪����Һ�п���ֻ����笠����ӣ���A����
B. ���ݷ�����֪����Һ��һ������NH4+��SO42-������Cl-��I-�е�һ�ֻ����֣�B����
C. ���ݷ�����֪����Һ��SO42-��Cl-��I-��NO3-�����ܴ��ڣ�C��ȷ��
D. ���ݷ�����֪����Һ�п��ܴ���K+��NO3-��D����
�ʺ���ѡ����C��


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�����ǵ绯ѧ��ص�һ�֣���Ҫ���ְ��������������缫�����ʡ�һ����˵��ԭ����ڵ�ع���ʱ����ij�ֻ�ѧ�仯�������������Ϊ��ѧ��أ�Ũ������ȻҲ������������ԭ���̣�����ص��ܷ�Ӧ�в�û�з�ӳ�����ֱ仯���侻���ý�����һ�����ʴӸ�Ũ��״̬���Ũ��״̬��ת�ơ���ͼ����������ͭ��Һ���ɵ�Ũ���ص�ʾ��ͼ,����˵���������( )
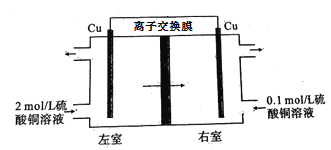
A.�������������ӽ���Ĥ
B.���ҷ�����Ӧ��Cu2++2e��=Cu
C.������������ͭ��Һ���ʵ���Ũ�ȵ���2 mol/L
D.����һ��ʱ������ҵ缫��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ��ö���������Ũ���ᷴӦ�Ʊ�������װ����ͼ1��ʾ��ͬʱ֤��������ijЩ���ʣ�װ����ͼ2��ʾ����Ҫ��ش��������⣺

��1���Ʊ�ʵ�鿪ʼʱ���ȼ��װ�õ������ԡ��������IJ���������_____������ĸ����
a ����ƿ�м���![]() ��ĩ b ���� c ��Һ©����װ��Ũ���ᣬ������������ƿ�м���Ũ����
��ĩ b ���� c ��Һ©����װ��Ũ���ᣬ������������ƿ�м���Ũ����
��2��д����ƿ�з�Ӧ�����ӷ���ʽ___��
��3���Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ���ͬѧ�����������![]() ��Һ��Ӧ���������ɵ�AgCl�������������������У�ԭ����_____��
��Һ��Ӧ���������ɵ�AgCl�������������������У�ԭ����_____��
��4��ͼ2�У�Ũ�����������____���Թ�A��B�г��ֵIJ�ͬ����˵������ʵ��____��
��5����������β���������մ�����װ����ͼ3��ʾ��
�ձ��е����ռ���ѡ��___������ţ���
�ٱ���ʳ��ˮ �ڳ���ʯ��ˮ �۱���NaOH��Һ
�ܱ���![]() ��Һ �ݱ���
��Һ �ݱ���![]() ��Һ
��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȼ�շ��ⶨij�ְ�����(CxHyOzNm)�ķ�����ɡ�ȡWg���ְ�������ڴ����г��ȼ�գ����ɶ�����̼��ˮ�͵���������ͼ��ʾװ�ý���ʵ�顣

�ش��������⣺
��1��ʵ�鿪ʼʱ������ͨ��һ��ʱ�����������������__________________��
��2������װ������Ҫ���ȵ�������_______ (��д��ĸ)������ʱӦ�ȵ�ȼ_____���ľƾ��ơ�
��3��Aװ���з�����Ӧ�Ļ�ѧ����ʽ��____________________________��
��4��Dװ�õ�������____________________________��
��5����ȡ���������ʱ��Ӧע����_________________����_________________��
��6��ʵ���в�õ��������ΪVmL(��״��)��Ϊȷ���˰�����ķ���ʽ������Ҫ���й�������____________________��
A�����ɶ�����̼���������
B������ˮ������
C��ͨ�����������
D�����������Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2CO3�ĵ��볣����K1��4.4��10��7��K2��4.7��10��11��HClO�ĵ��볣����2.95��10��8����Ӧ��Cl2��H2O![]() HCl��HClO�ﵽƽ���Ҫʹc(HClO)����ɼ���(����)
HCl��HClO�ﵽƽ���Ҫʹc(HClO)����ɼ���(����)
A.NaOHB.HClC.CaCO3(����)D.H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���
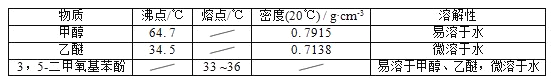
��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ1 L��pH������2������ʹ�����Һ�У��ֱ�Ͷ�������п������ͼ��ʾ���ܷ��Ͽ���ʵ����
A.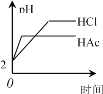 B.
B.
C. D.
D.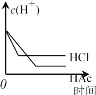
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(M)�dz��õ���������ʹҩ����ϳ�·�����£�
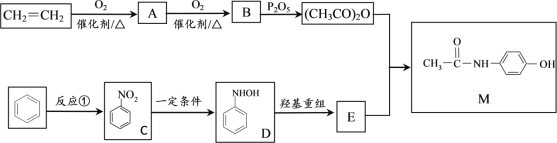
���������գ�
(1)A�Ľṹ��ʽΪ____________��C��D�ķ�Ӧ����Ϊ___________________��
(2)ʵ�����н��з�Ӧ�ٵ�ʵ��ʱ�����Լ���˳��Ϊ________________________��
(3)�����й�E��˵����ȷ����____________����ѡ���ţ�
a������ʽΪC6H6NO b��������ˮ�����ӳɷ�Ӧ
c������FeCl3��Һ�ܷ�����ɫ��Ӧ d�����ܺ�����������Һ��Ӧ�����ܺ����ᷴӦ
(4)��֪![]() ��
��![]() ���������ƣ�д��һ��������M��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��______________________
���������ƣ�д��һ��������M��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��______________________
(5)��������������M��ͬ���칹����_____________�֡�
�ٱ�����ֻ�����ֲ�ͬ��������ԭ�ӣ��ڱ��������У�NH2���������������ʡ�
(6)N-�ڱ��������ʰ���( )����Ҫ�Ļ����м��壬��ҵ�����ڶ��ױ��ʰ���(NH2-CH2-COOH)Ϊԭ��ͨ��һϵ�еķ�Ӧ��ȡ�û����������������̵������Ϣ��д�����һ����Ӧ�Ļ�ѧ����ʽ��_____________________
)����Ҫ�Ļ����м��壬��ҵ�����ڶ��ױ��ʰ���(NH2-CH2-COOH)Ϊԭ��ͨ��һϵ�еķ�Ӧ��ȡ�û����������������̵������Ϣ��д�����һ����Ӧ�Ļ�ѧ����ʽ��_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ��(���ķ���)�ķ�����ȷ����( )
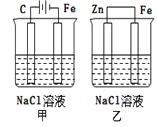
A.��װ������������������������
B.��װ������������������������
C.һ��ʱ���ס���װ����pH������
D.�ס���װ�������缫�ĵ缫��Ӧʽ��Ϊ��2H++2e��H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com