
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:

已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水。
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10-13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
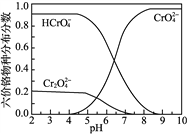
③六价铬在溶液中物种分布分数与pH关系如右图所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成。
(1)实验时需要配制100 mL 3mol·L-1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要的玻璃仪器是________。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是________。
(3) “氧化”时H2O2滴加速度不宜过快,其原因是____________________________;“氧化”时发生反应的离子方程式为__________________________________________________。
(4) “煮沸”的目的是________。
(5) 请设计用“冷却液”制备PbCrO4的实验方案:________[实验中须使用的试剂有:6 mol·L-1的醋酸, 0.5 mol·L-1Pb(NO3)2溶液, pH试纸]。
【答案】 100 mL容量瓶和胶头滴管 不断搅拌下逐滴加入NaOH溶液,至产生的绿色沉淀恰好溶解 减小H2O2自身分解损失 2CrO![]() +3H2O2 +2OH-===2CrO
+3H2O2 +2OH-===2CrO![]() +4H2O 除去过量的H2O2 在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸至弱酸性(pH略小于7),将溶液加热至沸腾,先加入一滴0.5 mol·L-1 Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥
+4H2O 除去过量的H2O2 在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸至弱酸性(pH略小于7),将溶液加热至沸腾,先加入一滴0.5 mol·L-1 Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥
【解析】(1)配置100mL3mol·L-1CrCl3溶液,需要的最关键的玻璃仪器是100mL容量瓶和胶头滴管;
(2)由于Cr(OH)3是两性氢氧化物,难溶于水的绿色沉淀,所以滴加NaOH溶液时,要在不断搅拌下直到绿色沉淀恰好完全溶解,即到NaCrO2溶液;
(3)H2O2用于将NaCrO2氧化为Na2CrO4,但H2O2不稳定,易分解,所以滴加速率不宜过快;反应的离子方程式为2CrO2-+3H2O2+2OH- =2CrO42-+4H2O;
(4)“煮沸”的目的是为除去过量的H2O2;
(5)“冷却液”的主要成分为Na2CrO4,要想制备PbCrO4,根据已知信息②由Pb(NO3)2提供Pb2+,但要控制溶液的pH不大于7.2,以防止生成Pb(OH)2沉淀,由信息③的图象可知,溶液的pH又不能小于6.5,因为pH小于6.5时CrO42—的含量少,HCrO4—的含量大,所以控制溶液的pH略小于7即可,结合信息④,需要先生成少许的PbCrO4沉淀,再大量生成。所以实验操作为:在不断搅拌下,向“冷却液”中滴加6mol·L-1的醋酸至pH略小于7,将溶液加热至沸,先加入一滴0.5mol·LPb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
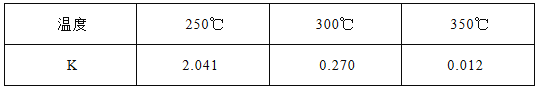
①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
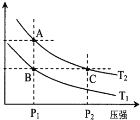
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) ![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法正确的是( )
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法正确的是( )
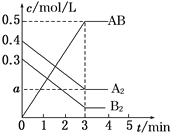
A. 图中a点的值为0.05
B. 平衡时A2的转化率为62.5%
C. 该反应的平衡常数K=0.03
D. 温度升高,平衡常数K值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小华在实验室进行以下实验:将四个完全相同的空心薄铁皮球分别放入四个盛有密度为ρ(g/cm3)的食盐水的烧杯中,铁球所处的位置如图所示。然后,他将水、密度均为ρ(g/cm3)的三种溶液(CuSO4、AgNO3、稀硫酸)分别加入上述四个烧杯中。回答下列问题:
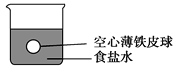
(1)加入水时,看到的现象是____________________________________________。
(2)加入稀硫酸时看到的现象是(假定整个反应过程中铁皮球壁完整)_____________________,发生反应的离子方程式是____________________________________________。
(3)加入CuSO4溶液时看到的现象是___________________________,发生反应的离子方程式是____________。
(4)加入AgNO3溶液时看到的现象是____________,发生反应的离子方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸米多君是临床常用的升压药,其一种合成路线如下:
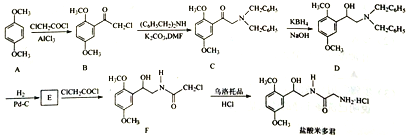
(1)盐酸米多君中含氧官能团名称为_____________(只写两种)。
(2)B→C的反应类型为___________。
(3)写出满足下列条件的B的一种同分异构体的结构简式:_______。
①含有苯环,分子中有一个手性碳原子,能发生银镜反应,与FeCl3溶液发生显色反应,在酸性条件下水解可生成两种有机物。
②分子中只有5种不同化学环境的氢。
(4)E的分子式为C10H15O3N,经取代得到F。写出E的结构简式:_______。
(5)已知:![]() ,请写出以
,请写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图______(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图______(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全矾电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+V2+(绿色)+2H+下列说法错误的是( )
VO2+(黄色)+V2+(绿色)+2H+下列说法错误的是( )
A. 放电时,正极反应为VO2++2H++e-=VO2++H2O
B. 放电过程中,正极附近溶液的酸性减弱
C. 充电时,阳极附近溶液由蓝色逐渐变为黄色
D. 充电时,反应每生成2mol H+时电子转移数为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为___________________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1
2C(s)+O2(g) ΔH2=+221 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH=_____________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a表示_____离子交换膜(填“阴”或“阳”)。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示_________,E表示___________。
②阳极的电极反应式为___________________________。
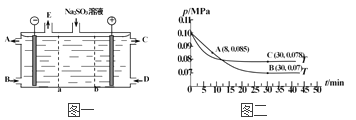
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com