
【题目】在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) ![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法正确的是( )
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法正确的是( )
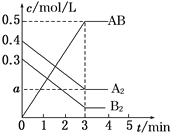
A. 图中a点的值为0.05
B. 平衡时A2的转化率为62.5%
C. 该反应的平衡常数K=0.03
D. 温度升高,平衡常数K值不变
【答案】B
【解析】A、当AB的浓度改变0.5 molL-1,由方程式A2(g)+B2(g) ![]() 2AB(g)知,A2的浓度改变为0.25molL-1,所以a=(0.4-0.25)molL-1=0.15molL-1,即图中a点的值为0.15,故A错误;B.当AB的浓度改变0.5 molL-1,由方程式知,A2的浓度改变为0.25molL-1,已知A2的初始量为0.4molL-1,所以平衡时A2的转化率为:
2AB(g)知,A2的浓度改变为0.25molL-1,所以a=(0.4-0.25)molL-1=0.15molL-1,即图中a点的值为0.15,故A错误;B.当AB的浓度改变0.5 molL-1,由方程式知,A2的浓度改变为0.25molL-1,已知A2的初始量为0.4molL-1,所以平衡时A2的转化率为: ![]() ×100%=62.5%,故B正确;C、当AB的浓度改变0.5 molL-1,由方程式知,B2的浓度改变为0.25molL-1,所以平衡时B2的浓度为=(0.3-0.25)molL-1=0.05molL-1,K=
×100%=62.5%,故B正确;C、当AB的浓度改变0.5 molL-1,由方程式知,B2的浓度改变为0.25molL-1,所以平衡时B2的浓度为=(0.3-0.25)molL-1=0.05molL-1,K=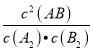 =
=![]() =
=![]() ,故C错误;D.反应A2(g)+B2(g)
,故C错误;D.反应A2(g)+B2(g) ![]() 2AB(g)的△H<0,为放热反应,所以温度升高,平衡逆移,平衡常数K值减小,故D错误;故选B。
2AB(g)的△H<0,为放热反应,所以温度升高,平衡逆移,平衡常数K值减小,故D错误;故选B。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】苄丙酮香豆素(H)常用于防治血栓栓塞性疾病,其合成路线如图所示(部分反应条件略去)。
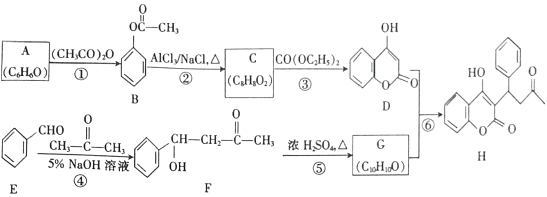
已知: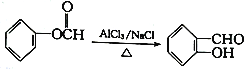
回答下列问题:
(1)A的名称是_________,H 中含氧官能团的名称是_________ 。
(2)反应①的反应类型是_________,反应④的反应类型是_________ 。
(3)C 的结构简式为_________ 。
(4)反应⑤的化学方程式为_________ 。
(5)F 的同分异构体中,满足下列条件的有_____种,其中核磁共振氢谱有7组峰,且峰面积之比为1:2:2:2:2:1:2的结构简式为__________。(任写一种)
①分子结构中除苯环外不含其他环,且不含甲基
②能和FeCl3溶液发生显色反应
③1mol该有机物能与2molNaOH 恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料(其他无机试剂任选)制备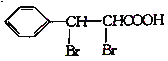 的合成路线。_____________
的合成路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。
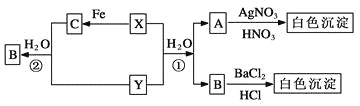
试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2) 反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某化学兴趣小组将无水三草酸合铁酸钾按如图所示装置进行实验。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
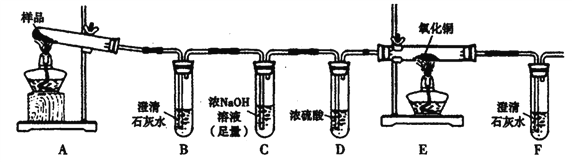
限选试剂:浓硫酸、1.0mol/L HNO3、1.0mol/L盐酸、1.0 mol/L NaOH.3% H2O2、0.1 mol/LKI、0.1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
I.若实验中,观察到B、F中溶液均变浑浊,则E中的现象是____,推测三草酸合铁酸钾分解的气体产物是____。该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设:假设l____;假设2____;假设3____。
(2)设计实验方案并验证
①取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
②取少量上述不溶固体放入试管中,加入足量____溶液,充分振荡。若溶液颜色及加入的不溶固体无明显变化,则假设____成立。若溶液颜色明显改变,且有暗红色固体生成,则证明有____存在。
③取②所得暗红色固体于试管中,滴加过量____,振荡后静置。取上层清液于试管中,滴加适量____,再滴加____,若溶液基本无色,则假设____成立;若溶液呈____,则假设_____成立。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在对胃肠做X射线透视时,需要服用一定量的硫酸钡,也就是俗称的“钡餐”透视。而可溶性的钡离子对人体是有毒的,因此做“钡餐”透视的物质必须进入人体仍然不溶于水。请你想一想:
(1)碳酸钡也是不溶于水的,能否用碳酸钡来做钡餐呢?为什么?________________________。
(2)若不慎将氯化钡误作“钡餐”服用,可以服用泻药(主要成分是硫酸镁)解毒,原因是什么?__________。
(3)请你写出(1)、(2)中有关反应的离子方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生物电化学方法脱除水体中NH4+的原理如下图所示:
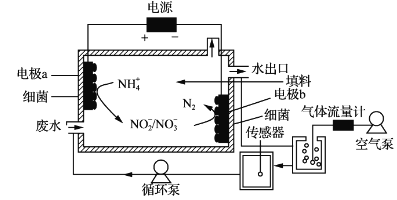
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄檀内酯是一种具有抗肿瘤、抗菌、抗氧化等生物活性的天然化合物,可由香兰素为原料合成(如下图所示)。
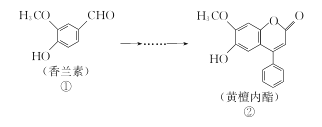
下列说法正确的是( )
A. ①、②分子中碳原子一定都处于同一平面
B. ①、②均能使酸性KMnO4溶液褪色
C. 化合物①能与NaHCO3反应产生CO2
D. 1 mol化合物②最多只能与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:

已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水。
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10-13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
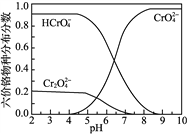
③六价铬在溶液中物种分布分数与pH关系如右图所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成。
(1)实验时需要配制100 mL 3mol·L-1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要的玻璃仪器是________。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是________。
(3) “氧化”时H2O2滴加速度不宜过快,其原因是____________________________;“氧化”时发生反应的离子方程式为__________________________________________________。
(4) “煮沸”的目的是________。
(5) 请设计用“冷却液”制备PbCrO4的实验方案:________[实验中须使用的试剂有:6 mol·L-1的醋酸, 0.5 mol·L-1Pb(NO3)2溶液, pH试纸]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A.1mol·L-1 KCl溶液中含有的氯离子数目为NA
B.常温常压下16gO2与16gO3含有的氧原子数目相等
C.标准状况下,22.4LH2O含有的原子数目为3NA
D.18gNH4+所含电子数为11NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com