
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某化学兴趣小组将无水三草酸合铁酸钾按如图所示装置进行实验。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
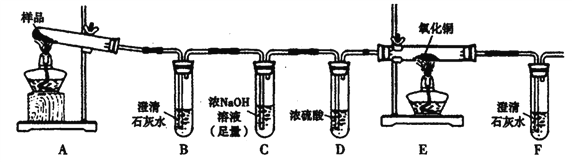
限选试剂:浓硫酸、1.0mol/L HNO3、1.0mol/L盐酸、1.0 mol/L NaOH.3% H2O2、0.1 mol/LKI、0.1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
I.若实验中,观察到B、F中溶液均变浑浊,则E中的现象是____,推测三草酸合铁酸钾分解的气体产物是____。该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设:假设l____;假设2____;假设3____。
(2)设计实验方案并验证
①取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
②取少量上述不溶固体放入试管中,加入足量____溶液,充分振荡。若溶液颜色及加入的不溶固体无明显变化,则假设____成立。若溶液颜色明显改变,且有暗红色固体生成,则证明有____存在。
③取②所得暗红色固体于试管中,滴加过量____,振荡后静置。取上层清液于试管中,滴加适量____,再滴加____,若溶液基本无色,则假设____成立;若溶液呈____,则假设_____成立。
【答案】 黑色粉末变红 CO和CO2 只有Fe 只有FeO 含有FeO和Fe CuSO4溶液 2 Fe HCl 20%KSCN 3%H2O2 1 血红色 3
【解析】试题分析:本题考查三草酸合铁酸钾晶体分解产物的实验探究。涉及CO2、CO的检验,Fe、FeO的性质以及Fe2+的检验,实验方案的设计。
I.若实验中观察到B中澄清石灰水变浑浊,说明分解产物中有CO2;通过C中足量的浓NaOH溶液将CO2除尽;观察到F中澄清石灰水变浑浊,说明产物通过灼热的CuO时生成了CO2,E中CO将CuO还原成Cu,则E中的现象为黑色粉末变红;根据上述现象推测三草酸合铁酸钾分解的气体产物为CO和CO2。
II.(1)固体产物中铁元素不可能以三价形式存在,则固体产物中Fe可能是0价、+2价,固体产物中铁元素存在形式的合理假设为:假设1只有Fe,假设2只有FeO,假设3为Fe和FeO的混合物。
(2)①固体产物加入足量蒸馏水溶解,过滤除去固体产物中的可溶性的K2CO3。
②根据题给试剂,以及Fe和FeO的性质,Fe能从CuSO4溶液中置换出暗红色的Cu,FeO与CuSO4溶液不反应,可向不溶固体中加入CuSO4溶液,观察CuSO4溶液颜色的变化确定固体产物中是否含Fe。取少量上述不溶固体放入试管中,加入足量CuSO4溶液,充分振荡;若溶液颜色及加入的不溶固体无明显变化,固体产物中不含Fe,则假设2成立;若溶液颜色明显改变,且有暗红色固体生成,固体产物中存在Fe。
③要确定暗红色固体中是否含FeO,可将暗红色固体溶于盐酸后再检验是否含Fe2+。实验方法是:取②所得暗红色固体于试管中,滴加过量1.0mol/LHCl,振荡后静置。取上层清液于试管中,滴加适量20%KSCN溶液,再滴加3%H2O2,若溶液基本无色,则暗红色固体中不含FeO,则假设1成立;若溶液呈血红色,则暗红色固体中含FeO,则假设3成立。


科目:高中化学 来源: 题型:
【题目】三室电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的(Na+和SO42-)可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )
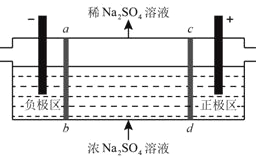
A. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
B. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
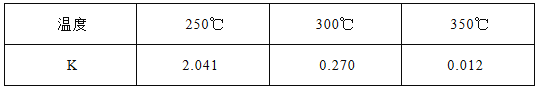
①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
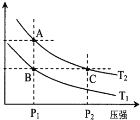
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷、乙烯是两种常见的有机物气体,为了区别它们,可将它们分别通入__________________。(填“氢氧化钠溶液”、“酸性高锰酸钾溶液”或“稀硫酸");
(2)乙醇和乙酸是生活中两种常见有机物,乙醇的官能团名称是_____________;乙醇和乙酸在浓硫酸作催化剂和加热的条件下发生反应,生成_________(写结构简式)和水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶解于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的是( )
A.①④②⑤①③B.①④⑤②①③C.①②⑤④①③D.①②④⑤①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处处留心皆知识.生活中遇到下列问题,不涉及到化学变化的是( )
A.食物腐败变质
B.浓硫酸在空气中体积增大
C.铝表面形成致密的薄膜
D.食醋洗掉水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) ![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法正确的是( )
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。下列说法正确的是( )
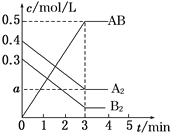
A. 图中a点的值为0.05
B. 平衡时A2的转化率为62.5%
C. 该反应的平衡常数K=0.03
D. 温度升高,平衡常数K值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小华在实验室进行以下实验:将四个完全相同的空心薄铁皮球分别放入四个盛有密度为ρ(g/cm3)的食盐水的烧杯中,铁球所处的位置如图所示。然后,他将水、密度均为ρ(g/cm3)的三种溶液(CuSO4、AgNO3、稀硫酸)分别加入上述四个烧杯中。回答下列问题:
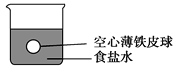
(1)加入水时,看到的现象是____________________________________________。
(2)加入稀硫酸时看到的现象是(假定整个反应过程中铁皮球壁完整)_____________________,发生反应的离子方程式是____________________________________________。
(3)加入CuSO4溶液时看到的现象是___________________________,发生反应的离子方程式是____________。
(4)加入AgNO3溶液时看到的现象是____________,发生反应的离子方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为___________________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1
2C(s)+O2(g) ΔH2=+221 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH=_____________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a表示_____离子交换膜(填“阴”或“阳”)。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示_________,E表示___________。
②阳极的电极反应式为___________________________。
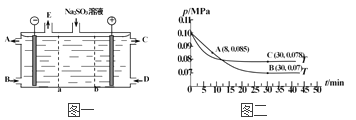
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com