


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①浓缩菠萝汁 ②蔗糖 ③柠檬黄 ④山梨酸钾 ⑤水 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装封口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4 |
| B、NaNO3 |
| C、FeSO4 |
| D、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应2FeCl3+Fe=3FeCl2中氧化产物与还原产物的质量比 |
| B、平均相对分子质量为34的混合气体中N2和NO2的体积比 |
| C、在密闭容器中,N2+3H2═2NH3已达平衡时NH3与N2的浓度比 |
| D、在12C16O2分子中的中子数和质子数之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H3+的电子式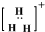 |
| B、H3+可在液氢中形成H4+、H5+、H6+ |
| C、H3+可在液氢中形成H5+、H7+、H9+ |
| D、每个H3+微粒中含有3个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com