
【题目】氮氧化物是形成酸雨、水体富营养化、光化学烟雾等环境问题的主要原因。
已知:反应Ⅰ.2NO(g)+O2(g)![]() 2NO2(g) ΔH1=-112 kJ/mol;
2NO2(g) ΔH1=-112 kJ/mol;
反应Ⅱ.2NO2(g)![]() N2O4(g) ΔH2=-24.2 kJ/mol;
N2O4(g) ΔH2=-24.2 kJ/mol;
反应Ⅲ.3O2(g)![]() 2O3(g) ΔH3=+144.6 kJ/mol;
2O3(g) ΔH3=+144.6 kJ/mol;
(1)大气层中O3氧化NO的热化学方程式为3NO(g)+O3(g)![]() 3NO2(g) ΔH4=________。
3NO2(g) ΔH4=________。
(2)某温度下,向1L刚性容器中投入1mol O2发生反应Ⅲ,5min时压强变为原来的0.9倍后不再变化。
①5min内O3的生成速率v(O3)=______________________。
②平衡时O2的转化率α(O2)________30%(填“>”“=”或“<”)。
(3)常温下,向压强为pkPa的恒压容器中充入2molNO和1molO2,发生反应Ⅰ和反应Ⅱ。平衡时NO和NO2的物质的量分别为0.2mol和1mol,则常温下反应Ⅱ的平衡常数Kp=____________kPa-1(已知气体中某成分的分压p(分)=![]() ×p(总),用含p的式子表示)。
×p(总),用含p的式子表示)。
(4)工业上常用氨气去除一氧化氮的污染,反应原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+
5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+![]() (T为开氏温度)。
(T为开氏温度)。
①该反应ΔH_______________0(填“>”“=”或“<”)。

②一定温度下,按进料比n(NH3)∶n(NO)=1∶1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是______________________;当反应温度高于380 ℃时,NO的去除率迅速下降的原因可能是____________________。
【答案】-240.3 kJ/mol 0.04 mol·L-1·min-1 = 0.68/p < 迅速上升是因为催化剂活性增强,上升缓慢是因为温度升高 迅速下降是因为催化剂失活
【解析】
(1)根据盖斯定律,将已知热化学方程式叠加,可求得待测反应的热化学方程式;
(2)根据在相同条件下,气体的压强之比等于气体的物质的量的比计算反应消耗的O2及产生的O3的物质的量,然后利用反应速率和物质转化率的定义式计算;
(3)根据物质反应转化关系,计算各种物质平衡时物质的量,并根据物质的量的比等于气体所占的压强之比,用平衡分压表示化学平衡常数;
(4)①根据温度与化学平衡常数的关系,结合平衡移动原理分析判断反应热效应;
②根据催化剂具有催化活性分析;任何催化剂的催化活性都有一定的温度范围,根据温度对催化剂的影响分析。
(1)由于反应热与反应途径无关,只与物质的始态和终态有关,将![]() ,整理可得,ΔH4=
,整理可得,ΔH4=![]() ΔH1-
ΔH1-![]() ΔH3=-240.3 kJ/mol。
ΔH3=-240.3 kJ/mol。
(2)①设5min时生成O3的物质的量为x,则由方程式3O2(g)![]() 2O3(g)中物质反应关系可知:每反应消耗3molO2,会同时产生2molO3,减小1mol,则生成O3xmol,消耗O2的物质的量是
2O3(g)中物质反应关系可知:每反应消耗3molO2,会同时产生2molO3,减小1mol,则生成O3xmol,消耗O2的物质的量是![]() mol,则平衡时O2的物质的量为(1-
mol,则平衡时O2的物质的量为(1-![]() )mol,由于在相同温度下,气体的物质的量n与压强p成正比,则0.9×n起始(O2)=n平衡(O2)+n平衡(O3),0.9×1 mol=(1-
)mol,由于在相同温度下,气体的物质的量n与压强p成正比,则0.9×n起始(O2)=n平衡(O2)+n平衡(O3),0.9×1 mol=(1-![]() )mol+x,解得x=0.2mol,所以O3的生成速率v(O3)=
)mol+x,解得x=0.2mol,所以O3的生成速率v(O3)= =0.04mol/(L·min)。
=0.04mol/(L·min)。
②平衡时O2的物质的量n平衡(O2)=1mol-![]() ×0.2mol=0.7 mol,平衡时O2的转化率α(O2)=
×0.2mol=0.7 mol,平衡时O2的转化率α(O2)=![]() ×100%=30%。
×100%=30%。
(3)假设先进行反应Ⅰ,达到平衡后再进行反应Ⅱ,进行反应Ⅰ:2NO(g)+O2(g)![]() 2NO2(g),反应开始时n(NO)=2mol,n(O2)=1mol,由于平衡时n(NO)=0.2mol,反应了2mol-0.2mol=1.8mol,所以反应O2的物质的量为
2NO2(g),反应开始时n(NO)=2mol,n(O2)=1mol,由于平衡时n(NO)=0.2mol,反应了2mol-0.2mol=1.8mol,所以反应O2的物质的量为![]() ×1.8mol=0.9mol,剩余O2的物质的量为1mol-0.9mol=0.1mol,则反应I产生NO2物质的量为1.8mol;
×1.8mol=0.9mol,剩余O2的物质的量为1mol-0.9mol=0.1mol,则反应I产生NO2物质的量为1.8mol;
对于反应Ⅱ:2NO2(g)![]() N2O4(g),反应开始时n(NO2)=1.8mol,平衡时n(NO2)平=1mol,△n(NO2)=1.8mol-1mol=0.8mol,则此时n(N2O4)=
N2O4(g),反应开始时n(NO2)=1.8mol,平衡时n(NO2)平=1mol,△n(NO2)=1.8mol-1mol=0.8mol,则此时n(N2O4)=![]() ×0.8mol=0.4mol,所以平衡时n(总)=n(NO)+n(O2)+n(NO2)+n(N2O4)=0.2mol+0.1mol+1mol+0.4 mol=1.7mol,此时p(NO2)=
×0.8mol=0.4mol,所以平衡时n(总)=n(NO)+n(O2)+n(NO2)+n(N2O4)=0.2mol+0.1mol+1mol+0.4 mol=1.7mol,此时p(NO2)= ×p(总)=
×p(总)=![]() p kPa,p(N2O4)=
p kPa,p(N2O4)=![]() p kPa,所以常温下反应Ⅱ的平衡常数Kp=
p kPa,所以常温下反应Ⅱ的平衡常数Kp=![]() kPa-1。
kPa-1。
(4)①根据该反应的平衡常数与温度的关系式lg Kp=5.0+![]() 可知,随着温度升高,平衡常数降低,说明升高温度,化学平衡逆向移动,所以该反应的正反应为放热反应。
可知,随着温度升高,平衡常数降低,说明升高温度,化学平衡逆向移动,所以该反应的正反应为放热反应。
②随反应温度变化,在反应开始时迅速上升是因为催化剂活性增强,之后上升缓慢是因为温度升高,催化剂的催化活性降低;当反应温度高于380℃时,NO的去除率迅速下降的原因可能是由于催化剂失去催化活性。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有一份Fe2(SO4)3和(NH4)2SO4的混合溶液,向该溶液中加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液的体积关系如图。

(1)Ba(OH)2溶液的物质的量浓度为___________mol·L-1。
(2)该混合溶液中Fe2(SO4)3和(NH4)2SO4物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据相关实验得出的结论正确的是
选项 | 实验步骤 | 现象 | 结论 |
A | 浓硫酸与乙醇加热,产生的气体X直接通入溴水 | 溴水褪色 | X一定是纯净的乙烯 |
B | 某卤代烃CH3CH2X与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加 | 生成淡黄色沉淀 | X为溴原子 |
C | 向苯酚溶液中滴加少量浓溴水、振荡, | 无白色沉淀 | 苯酚浓度小 |
D | 鸡蛋白溶液中分别加入饱和(NH4)2SO4溶液和HgCl2溶液 | 均有白色沉淀 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L盐酸或NaOH溶液滴定体积均为20 mL,浓度均为0.1mol/L的MOH、HX溶液,滴定曲线如图所示。下列说法错误的是

A.两个滴定实验均可用酚酞作指示剂
B.常温下0.1mol/LMX溶液的pH<7
C.a点溶液中存在:c(X-)>c(HX)
D.b点溶液中存在:2c(MOH)+c(M+)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的常见化合价与原子序数的关系图:
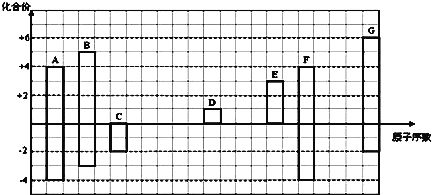
注:答题时,A—G所有元素都用其对应的元素符号表示。
(1)画出A的原子结构示意图______________;
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物(H的稳定氧化物为液态)时放出的热量为QkJ,请写出表示1molA2H6完全燃烧的热化学方程式:_____________;
(3)用电子式表示D2G的形成过程______________;其所含化学键类型为________;
(4)C2-、D+、G2-离子半径大小顺序是___>____>____;
(5)C、G元素所形成的氢化物稳定性为___>____(填化学式),原因是:______________;
(6)某同学设计实验证明A、B、F的非金属性强弱关系, 装置如图。
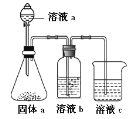
①溶液a和b分别为_________,__________;
②溶液c中发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲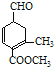 、乙
、乙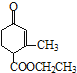 两种有机物,下列说法中不正确的是( )
两种有机物,下列说法中不正确的是( )
A.可用新制的氢氧化铜悬浊液区分这两种有机物
B.甲、乙互为同分异构体
C.甲在酸性和碱性条件下都能发生水解反应
D.等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O==NaN3+NaOH+NH3,3NaNH2+NaNO3==NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是________,第一电离能最小的元素是_______。
(2)基态氮原子的L层电子排布图为_________________。
(3)与N3-互为等电子体的分子为_________(写出一种)。依据价层电子对互斥理论,NO3-的空间构型是______________,其中心原子杂化类型是__________。
(4)叠氮化钠中不含有的化学键类型有_____________。
A.离子键 B.极性共价键 C.σ键 D.π键
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )
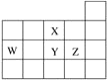
A.W、Y、X三种元素的原子半径依次减小
B.Z元素的简单气态氢化物的热稳定性比Y的高
C.Z的非金属性比Y的强,所以Z氢化物的沸点比Y的高
D.Y元素的单质能从NaZ溶液中置换出Z元素的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com