
【题目】以烃A为原料合成医用麻醉药苄佐卡因和食品防腐剂尼泊金酸乙酯的路线如下:
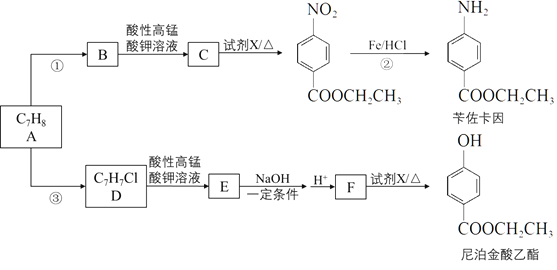
完成下列填空
(1)A的结构简式是____________。工业上A的来源通常是_______________。
(2)反应①的化学方程式是_____________________。
(3)反应②的反应类型是____________。
(4)反应③的试剂与条件是_______________。
(5)F的结构简式是_____________________。
(6)尼泊金酸乙酯有多种同分异构体,任写一种符合下列要求的同分异构体的结构简式____________。
i. 能发生银镜反应且分子中不含甲基
ii. 苯环上有两个对位取代基
(7)以A为起始原料,可以合成涂改液的主要成分亚甲基环己烷(![]() ),写出其合成线路。___________________。
),写出其合成线路。___________________。
(合成路线常用的表示方式为:![]() )
)
【答案】![]() 煤的干馏 :
煤的干馏 :![]() +HNO3(浓)
+HNO3(浓)![]()
![]() +H2O 还原反应 Cl2/FeCl3
+H2O 还原反应 Cl2/FeCl3 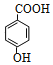
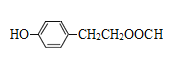 、
、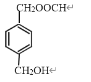 、
、 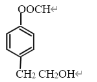 、
、
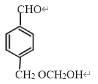 、
、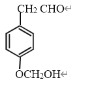 任写一种即可
任写一种即可 ![]()
【解析】
根据后续流程可知A中含有苯环,其分子式为C7H8,可知A为甲基苯,B到C为氧化反应,苯环上的甲级可以被氧化成羧基,所以C到![]() 为酯化反应,X为CH3CH2OH,则A到B引入了硝基,为与浓硝酸的取代反应;A到D为取代反应,F到尼泊金酸乙酯为酯化反应,尼泊金酸乙酯分子中有酚羟基,则E到F为氯代烃的取代,F为
为酯化反应,X为CH3CH2OH,则A到B引入了硝基,为与浓硝酸的取代反应;A到D为取代反应,F到尼泊金酸乙酯为酯化反应,尼泊金酸乙酯分子中有酚羟基,则E到F为氯代烃的取代,F为 ,E为
,E为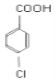 ,D为
,D为![]() ,故A到D是氯原子取代了苯环上的氢。据此进行解答。
,故A到D是氯原子取代了苯环上的氢。据此进行解答。
(1)A为甲基苯,其结构简式为![]() ,煤干馏得到煤焦油,煤焦油中含甲苯、苯等;故答案为:
,煤干馏得到煤焦油,煤焦油中含甲苯、苯等;故答案为:![]() ;煤的干馏;
;煤的干馏;
(2)反应①为甲苯与浓硝酸的取代,故答案为:![]() +HNO3(浓)
+HNO3(浓)![]()
![]() +H2O;
+H2O;
(3)反应②由![]() 到苄佐卡因,过程中去氧加氢,故为还原反应,故答案为:还原反应;
到苄佐卡因,过程中去氧加氢,故为还原反应,故答案为:还原反应;
(4)反应③为氯原子取代苯环上的氢,该反应需要FeCl3做催化剂,故答案为:Cl2/FeCl3;
(5)根据分析可知答案为: ;
;
(6)尼泊金酸乙酯结构简式可知其不饱和度为5,则其同分异构体不饱和度也为5,根据“能发生银镜反应且分子中不含甲基”可知其含有—CHO结构,且没有—CH3,;又 “苯环上有两个对位取代基”,所以同分异构体有:
 、
、 、
、  、
、
 、
、 任写一种即可;
任写一种即可;
(7)![]() 可由
可由![]() 发生消去反应得到,
发生消去反应得到,![]() 可由
可由![]() 发生加成反应得到,
发生加成反应得到,![]() 可由甲苯发生取代反应得到,其合成路线为
可由甲苯发生取代反应得到,其合成路线为![]() ,
,
故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.含有大量Al3+的溶液: Na+、SO![]() 、Cl-、NO
、Cl-、NO![]()
B.使酚酞变红色的溶液:Na+、Ca2+、CO![]() 、K+
、K+
C.0.1mol·L-1FeCl3溶液: K+、Na+、Br-、SCN-
D.0.1mol·L-1NaHCO3溶液: Na+、H+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气的用途非常广泛。实验室用如下装置制取氯气,并用制取氯气进行性质探究实验。回答下列问题:
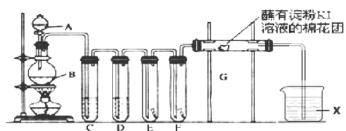
(1)A中盛有浓盐酸,B中盛有![]() ,写出反应的离子方程式__________________。
,写出反应的离子方程式__________________。
(2)E中为红色干布条,F中为红色湿布条,对比E和F中观察现象的差异可得出的结论是__________________。
(3)试管C和D中试剂名称各为_____________________。X试剂的作用是______________。
(4)装置G处发生反应的离子方程式为_____________________________。
(5)家庭中常用消毒液(主要成分![]() )与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒氯气,写出反应的离子方程式____________。
②需“密闭保存”的原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和体积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
A. 可逆反应停止 B. I2浓度不再变化
C. HI浓度不再变化 D. 混合气体颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了可控结构单壁碳纳米管的制备难题。海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、锰、锌、钴等。
(1)基态铬原子的核外未成对电子数为________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为________。
(2)纳米结构氧化钴可在室温下将甲硫醛![]() 完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中
完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中![]() 键与
键与![]() 键的个数比为________。
键的个数比为________。
(3)六羰基钨![]() 的熔点为
的熔点为![]() ,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________
,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________![]() 填元素符号
填元素符号![]() 。配体CO中与W形成配位键的原子是C非O,原因是________________________。
。配体CO中与W形成配位键的原子是C非O,原因是________________________。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”。下列分子中存在“离域
键”。下列分子中存在“离域![]() 键”的有________
键”的有________![]() 填字母
填字母![]() 。
。
A.环己烷 ![]() 二氧化硫
二氧化硫 ![]() 三氟化氮
三氟化氮 ![]() 苯酚
苯酚
(5)![]() 、
、![]() 能与
能与![]() 络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
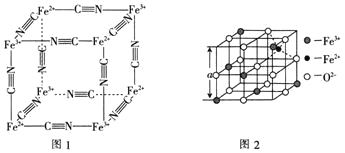
(6)图2是从铁氧体离子晶体![]() 中取出的能体现其晶体结构的一个立方体。已知
中取出的能体现其晶体结构的一个立方体。已知![]() 晶体的密度为
晶体的密度为![]() ,则图2中
,则图2中![]() ________
________![]() 已知
已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N和Si能形成多种高硬度材料,如![]() 、
、![]() 、SiC
、SiC
(1)![]() 和
和![]() 中硬度较高的是______,理由是______。
中硬度较高的是______,理由是______。
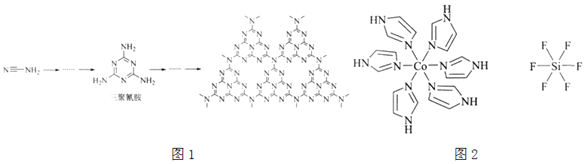
(2)![]() 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
(3)![]() 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑![]() 简写为
简写为![]() ,其结构为
,其结构为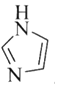
![]() 化合物
化合物![]() 的结构示意图如图2:
的结构示意图如图2:
①阳离子![]() 和
和![]() 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。![]() 例如水中氢键的表示式为
例如水中氢键的表示式为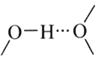
![]()
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”
键”![]() ,则im分子中存在的“离域
,则im分子中存在的“离域![]() 键”是______。
键”是______。
(4)![]() 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C:![]() ;
;![]() ;
;![]() 0,
0,![]() ,
,![]() ;
;![]() ;
;![]()
Si:![]() ;
;![]() ;
;![]() ;
;![]()
则![]() 立方晶胞中含有______个Si原子、______个C原子。
立方晶胞中含有______个Si原子、______个C原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2![]() 2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:830℃,在一个密闭容器中发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
A. v正= v逆B. v正> v逆C. v正< v逆D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com