
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( ) 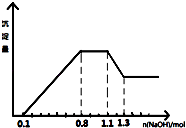
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32﹣和NO3﹣ , 一定含有SO42﹣
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
【答案】B
【解析】解:A、据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,所以溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+ , 故A错误;
B、加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有CO ![]() ,因为硝酸根、氢离子与锌会反应生成刺激性的一氧化氮,故无NO3﹣ , 但由于溶液一定显电中性,故溶液中一定含SO42﹣ , 故B正确;
,因为硝酸根、氢离子与锌会反应生成刺激性的一氧化氮,故无NO3﹣ , 但由于溶液一定显电中性,故溶液中一定含SO42﹣ , 故B正确;
C、根据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,根据第二段是氢氧化钠与铵根反应得到一水合氨的阶段,即NH4++OH﹣=NH3H2O,消耗氢氧化钠的物质的量为0.7mol﹣0.5mol=0.2mol,所以溶液中n(NH4+)=0.2mol,但由于溶液体积不明确,故溶液中的c(NH ![]() )不明确,故C错误;
)不明确,故C错误;
D、根据第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是0.1mol,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即Al(OH)3~OH﹣~[Al(OH)4]﹣ , 则消耗氢氧化钠的物质的量为:0.8mol﹣0.7mol=0.1mol,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据Al3+~3OH﹣~Al(OH)3 , Mg2+~2OH﹣~Mg(OH)2 , 0.1mol氢氧化铝消耗氢氧化钠的物质的量是0.3mol,所以镁离子消耗氢氧化钠的物质的量是:0.5mol﹣0.1mol﹣0.3mol=0.1mol,所以镁离子的物质的量是0.05mol,即n(H+):n(Al3+):n(Mg2+)=0.1:0.1:0.05=2:2:1,故D错误.
故选B.
加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有碳酸根和硝酸根离子,加氢氧化钠产生白色沉淀说明不含铁离子,当溶液中含氢离子、铵根离子、镁离子、铝离子时,加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,对应图象是先在x轴上,再逐渐增大,再平行x轴,再减小,可以对照图象求出各离子的量.


科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性.试回答下列问题:
(1)P的原子结构示意图为;
(2)NaH2PO2为(填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 .
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4:1,则该反应的氧化产物的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点比含相同碳原子的烷烃的沸点高的主要原因是( )
A.乙醇的分子量比含相同碳原子的烷烃的分子量大
B.乙醇分子之间易形成氢键
C.碳原子与氢原子的结合程度没碳原子与氧原子的结合程度大
D.乙醇是液体,而乙烷是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作: ![]()
则甲、乙、丙三种溶液可能是( )
A.BaCl2、H2SO4、MgCl2
B.CaCl2、HNO3、AgNO3
C.CaCl2、HNO3、NaCl
D.BaCl2、HCl、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液;②苯和四氯化碳的混合溶液;③单质溴和硝酸钠的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏B. 萃取、蒸馏、分液
C. 蒸馏、萃取、分液D. 分液、蒸馏、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)反应Fe(s)+CO2(g)FeO(s)+CO(g)△H1 , 平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g)△H2 , 平衡常数为K2 . 在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应 CO2(g)+H2(g)CO(g)+H2O(g)△H,平衡常数K,则△H=(用△H1和△H2表示),K=(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为;
②下列措施中能使平衡时 ![]() 增大的是(填序号)
增大的是(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母).
a.容器中压强不变 b.气体的密度不再改变c.v正(CO2)=v逆(CO) d.c(CO2)=c(CO) e.容器内气体总物质的量不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图. 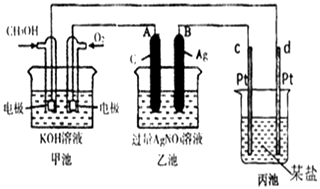
(1)请回答图中甲池是装置,其中OH﹣移向极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为极(填“A”或“B”),并写出此电极反应的电极反应式 .
(4)乙池中反应的离子方程式为 .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.该原子的摩尔质量是aNA
B.Wg该原子的物质的量一定是 ![]() mol
mol
C.Wg该原子中含有 ![]() 个该原子
个该原子
D.由已知信息可得:NA= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下几种物质①熔融氯化钠 ②液态氯化氢 ③Cu ④蔗糖 ⑤KAl(SO4)2⑥NaHCO3溶液,填空回答:(填序号)
(1)以上物质中属于电解质的是; 属于非电解质的是;能导电的是 .
(2)写出⑤的电离方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com