
����Ŀ���ۺ��⡣
��1����ӦFe��s��+CO2��g��FeO��s��+CO��g����H1 �� ƽ�ⳣ��ΪK1����ӦFe��s��+H2O��g��FeO��s��+H2��g����H2 �� ƽ�ⳣ��ΪK2 �� �ڲ�ͬ�¶�ʱK1��K2��ֵ�����
700�� | 900�� | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
�ٷ�Ӧ CO2��g��+H2��g��CO��g��+H2O��g����H��ƽ�ⳣ��K�����H=���á�H1�͡�H2��ʾ����K=����K1��K2��ʾ�����������������֪����ӦCO2��g��+H2��g��CO��g��+H2O��g������Ӧ������ȡ����ȡ�����
��2��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬������ӦFe��s��+CO2��g��FeO��s��+CO��g����H��0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
�ٸ������·�Ӧ��ƽ�ⳣ��Ϊ��
�����д�ʩ����ʹƽ��ʱ ![]() �������������ţ�
�������������ţ�
A�������¶� B������ѹǿ
C������һ������CO2 D���ټ���һ��������
��һ���¶��£���һ���̶��ݻ����ܱ������з���������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����������ĸ����
a��������ѹǿ���� b��������ܶȲ��ٸı�c��v����CO2��=v����CO�� d��c��CO2��=c��CO�� e�����������������ʵ������䣮
���𰸡�
��1����H1����H2��![]() ������
������
��2��2.0��A��bc
���������⣺��1����Fe��s��+CO2��g��FeO��s��+CO��g����H1 �� ƽ�ⳣ��ΪK1���ڷ�ӦFe��s��+H2O��g��FeO��s��+H2��g����H2 �� ƽ�ⳣ��ΪK2 ��
��ϸ�˹���ɿ�֪���٩��ڵõ�CO2��g��+H2��g��CO��g��+H2O��g����
���H=��H1����H2��K= ![]() ����ϱ������ݿ�֪
����ϱ������ݿ�֪ ![]() ��
�� ![]() ���������¶�K��������ӦΪ���ȷ�Ӧ��
���������¶�K��������ӦΪ���ȷ�Ӧ��
���Դ��ǣ���H1����H2�� ![]() �����ȣ���2����Fe��s��+CO2��g��FeO��s��+CO��g��
�����ȣ���2����Fe��s��+CO2��g��FeO��s��+CO��g��
��ʼ 1.5 0
ת�� 1 1
ƽ�� 0.5 1
�÷�Ӧ ��ƽ�ⳣ��K= ![]() =2.0��
=2.0��
���Դ��ǣ�2.0����A���ɱ�����K1�ı仯������ӦΪ���ȷ�Ӧ���������¶ȣ�ƽ�������ƶ�����ʹƽ��ʱ ![]() ����Aѡ��
����Aѡ��
B������ѹǿ��ƽ�ⲻ�ƶ�����B��ѡ��
C������һ������CO2 �� ƽ�������ƶ�����ƽ��ʱ ![]() ��С����C��ѡ��
��С����C��ѡ��
D���ټ���һ�������ۣ�ƽ�ⲻ�ƶ�����D��ѡ��
���Դ��ǣ�A����a���÷�ӦΪ�������ķ�Ӧ��������ѹǿʼ�ղ��䣬�����ж�ƽ��״̬���ʲ�ѡ��
b��������䣬������Ϊ������������ܶȲ��ٸı䣬Ϊƽ��״̬����ѡ��
c��v����CO2��=v����CO������֪���淴Ӧ������ȣ�Ϊƽ��״̬����ѡ��
d��c��CO2��=c��CO��������ʼŨ�ȡ�ת�����йأ������ж�ƽ��״̬���ʲ�ѡ��
e�����������������ʵ���ʼ�ղ��䣬�����ж�ƽ��״̬���ʲ�ѡ��
���Դ��ǣ�bc��
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ʼ����������֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��������ȷ�����⣮


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����ǿ������Һ�У������ܴ��������һ��������(����)
A. K+��Na+��NO3����Fe2+B. K+��NH4+��OH����Fe3+
C. K+��Na+��Br����HCO3��D. Mg2+��Na+��Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������������������أ�����˵������ȷ����
A. �������þ�������뽺��������
B. ���ø�ƿ����Һ�Ȼ�Ũ����
C. ����������ҽ���кͼ��е�һ�֣���ʹθҺŨ�Ƚ��ͣ����к�θ������á�
D. ����������������Ч��ֹ���ꡣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݡ��ο���Ϣ���������п�ѧ��������ǡ�21���͵���Դ������δ����ʯ�͡��Ĺ۵㣮
��1���������������ȼ�յ��Ȼ�ѧ����ʽΪSi��s��+O2��g���TSiO2��s����H=��989.2kJmol��1 �� �йؼ����������±���
��ѧ�� | Si��O | O=O | Si��Si |
����kJmol��1 | x | 498.8 | 176 |
��֪1molSi�к�2molSi��Si����1molSiO2�к�4molSi��O������x��ֵΪ ��
��2���������Ϊһ���ձ�ʹ�õ�������Դ���������ã��������������ص�����˵���У�����Ϊ�������� ��
A.��������䡢���棬�Ӱ�ȫ�Ƕȿ��ǣ�������ѵ�ȼ��
B.�����Դ�ḻ�����ڿ��ɣ��ҿ�����
C.��ȼ�շų�����������ȼ�ղ���Ի�����Ⱦ�̶ȵͣ�������Ч����
D.Ѱ�Ҹ�Ч�´���������ʹ��ӦSiO2+2C ![]() Si+2CO���ڳ����·������ǹ���Դ�������õĹؼ�����
Si+2CO���ڳ����·������ǹ���Դ�������õĹؼ�����
��3����ҵ�Ʊ�����ķ�ӦΪ2H2��g��+SiCl4��g���TSi��s��+4HCl��g����H=+240.4kJmol��1 �� ���ɵ�HClͨ��100mL 1molL��1��NaOH��Һǡ����ȫ�����գ��������Ʊ�����ķ�Ӧ������������ա����ͷš���������ΪkJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32����SO42����NO3���еļ��֣���������п����������ɫ��ζ�����壻��������NaOH��Һ��������ɫ�������Ҳ����ij����������NaOH�����ʵ���֮��Ĺ�ϵ��ͼ��ʾ��������˵����ȷ���ǣ� �� 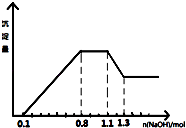
A.��Һ�е�������ֻ��H+��Mg2+��Al3+���ܺ���Fe3+
B.��Һ��һ������CO32����NO3�� �� һ������SO42��
C.��Һ��c��NH4+��=0.3 mol/L
D.c��H+����c��Al3+����c��Mg2+��=1��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ںϳ���֬���м�������˫��F������ʽΪC13H8Br4O2����ҩ�����Բ��ϸ߷��ӻ�����PCL{���ڵĻ�ѧʽΪ[C6H10O2]n}�ĺϳ�·�����£�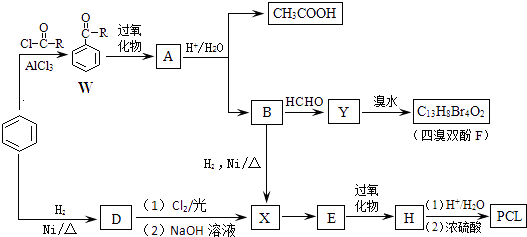
��֪ ![]()
����������ϳ�·���Լ���ط�Ӧԭ���ش��������⣺
��1��W�Щ�RΪ ��
��2��A�Ľṹ��ʽ�� ��
��3��A����B��CH3COOH�ķ�Ӧ�������� ��
��4��D��X��Ӧ������������Ĺ����ŷֱ��� ��
��5����֪E�ķ���ʽΪC6H10O��E��������ﷴӦ������H����H�Ľṹ��ʽ�� ��
��6���л���Y�ı�����ֻ��2�ֲ�ͬ��ѧ��������ԭ�ӣ�����B����Y�Ļ�ѧ����ʽΪ ��
����Y��������˫��F�Ļ�ѧ����ʽΪ�� ��
������ͬ�����£���Bת��������˫��F�Ĺ����п����и��������ɣ���֪�ø�����������˫��F��ͬ���칹�壬д������һ�ָ�����Ľṹ��ʽ ��
��7���߷��ӻ�����PCL�Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L���ܱ������У�����1mol X(g)��2mol Y(g)������Ӧ��X(g)��mY(g) ![]() 3Z(g)��ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1mol Z(g)���ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
3Z(g)��ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1mol Z(g)���ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
A. m=2 B. �ڶ���ƽ��ʱ��Z��Ũ��Ϊ0.4mol/L
C. X��Y��ƽ��ת����֮��Ϊ1:1 D. ����ƽ���ƽ�ⳣ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������������ǣ� �� 
A.ͼ1��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯
B.ͼ2��ʾ0.1000molL��1NaOH��Һ�ζ�20.00mL0.1000molL��1CH3COOH��Һ���õ��ĵζ�����
C.ͼ3��ʾKNO3���ܽ�����ߣ�ͼ��a����ʾ����Һ��80��ʱKNO3�IJ�������Һ
D.ͼ4 ��ʾij���淴Ӧ����������淴Ӧʱ��仯�����ߣ���ͼ֪tʱ��Ӧ��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʼȲ�����ͬϵ�Ҳ������ͬ���칹����ǣ� ��
A. ���ȼױ��Ͷ��ȼױ� B. һ�ȼ���Ͷ�������
C. �����Ӳ֬�� D. ���Ǻ���ѿ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com