
【题目】已知用于合成树脂的中间体四溴双酚F(分子式为C13H8Br4O2)、药物透过性材料高分子化合物PCL{链节的化学式为[C6H10O2]n}的合成路线如下: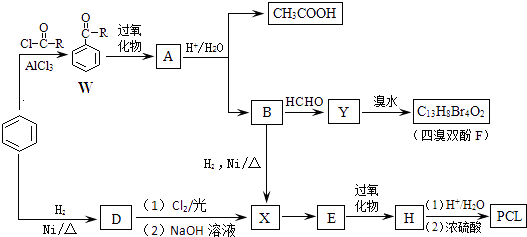
已知 ![]()
请根据上述合成路线以及相关反应原理回答下列问题:
(1)W中﹣R为 .
(2)A的结构简式是 .
(3)A生成B和CH3COOH的反应类型属于 .
(4)D→X反应过程中所引入的官能团分别是 .
(5)已知E的分子式为C6H10O,E与过氧化物反应可生成H,则H的结构简式是 .
(6)有机物Y的苯环上只有2种不同化学环境的氢原子.①由B生成Y的化学方程式为 .
②由Y生成四溴双酚F的化学方程式为: .
③在相同条件下,由B转化成四溴双酚F的过程中可能有副产物生成.已知该副产物是四溴双酚F的同分异构体,写出其中一种副产物的结构简式 .
(7)高分子化合物PCL的结构简式是 .
【答案】
(1)甲基
(2)![]()
(3)水解反应或取代反应
(4)氯原子、羟基
(5)![]()
(6)![]() ;
;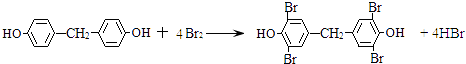 ;
;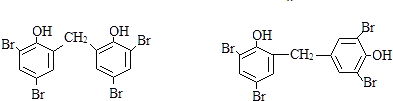
(7)![]()
【解析】解:A水解得到乙酸与B,则A属于酯,结合W的结构可知,A为醋酸苯酚酯,即A为 ![]() ,故W中﹣R是﹣CH3 , B为
,故W中﹣R是﹣CH3 , B为 ![]() .苯与氢气发生加成反应生成D为
.苯与氢气发生加成反应生成D为 ![]() ,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为
,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为 ![]() ,由(5)中E的分子式是C6H10O,E与H2反应可生成X,则X发生催化氧化生成E为
,由(5)中E的分子式是C6H10O,E与H2反应可生成X,则X发生催化氧化生成E为 ![]() ,结合W到A的转化,可知E与过氧化物反应生成酯,故H为
,结合W到A的转化,可知E与过氧化物反应生成酯,故H为 ![]() ,H发生水解反应得到HOCH2CH2CH2CH2CH2COOH,再在浓硫酸条件下发生水解反应生成PCL为
,H发生水解反应得到HOCH2CH2CH2CH2CH2COOH,再在浓硫酸条件下发生水解反应生成PCL为 ![]() .苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为
.苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为 ![]() ,F为
,F为 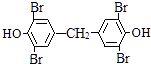 ,(1)通过以上分析知,W中﹣R是﹣CH3 , 所以答案是:甲基;(2)A的结构简式是
,(1)通过以上分析知,W中﹣R是﹣CH3 , 所以答案是:甲基;(2)A的结构简式是 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)A生成B和CH3COOH的反应类型属于水解反应或取代反应,所以答案是:水解反应或取代反应;(4)D→X反应过程中所引入的官能团分别是氯原子、羟基,所以答案是:氯原子;羟基;(5)E的分子式为C6H10O,E与过氧化物反应可生成H,则H的结构简式是
;(3)A生成B和CH3COOH的反应类型属于水解反应或取代反应,所以答案是:水解反应或取代反应;(4)D→X反应过程中所引入的官能团分别是氯原子、羟基,所以答案是:氯原子;羟基;(5)E的分子式为C6H10O,E与过氧化物反应可生成H,则H的结构简式是 ![]() ,所以答案是:
,所以答案是: ![]() ;(6)有机物Y的苯环上只有2种不同化学环境的氢原子,Y为
;(6)有机物Y的苯环上只有2种不同化学环境的氢原子,Y为 ![]() ,①由B生成Y的反应方程式是:
,①由B生成Y的反应方程式是: ![]() ,所以答案是:
,所以答案是: ![]() ;②由Y生成四溴双酚F的反应方程式是:
;②由Y生成四溴双酚F的反应方程式是: 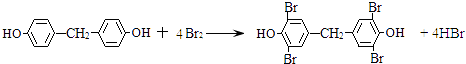 ,所以答案是:
,所以答案是: 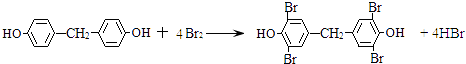 ;③在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,可能是2分子苯酚与甲醛为邻位脱水,或者中为邻位、对位脱水,再与溴水发生取代反应得到,故该副产物的结构简式可能是
;③在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,可能是2分子苯酚与甲醛为邻位脱水,或者中为邻位、对位脱水,再与溴水发生取代反应得到,故该副产物的结构简式可能是 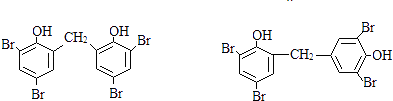 ,所以答案是:
,所以答案是: 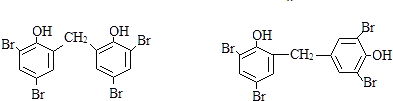 ;(7)由上述分析可知,高分子化合物PCL的结构简式是
;(7)由上述分析可知,高分子化合物PCL的结构简式是 ![]() ,所以答案是:
,所以答案是: ![]()


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】某氮肥样品可能含有NH4HCO3,NH4Cl、NH4NO3中的一种或几种,称取该样品1.000克,溶于水配成100mL溶液、将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL 0.2mol/L的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol/L氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mL 0.15mol/L的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO3 0.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4C1
C. 原样品的含氮量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式是: 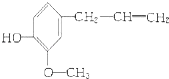 该物质不应有的化学性质是( ) ①可以燃烧
该物质不应有的化学性质是( ) ①可以燃烧
②可以跟溴加成
③可以将KMnO4酸性溶液还原
④可以跟NaHCO3溶液反应
⑤可以跟NaOH溶液反应
⑥可以发生消去反应.
A.①③
B.③⑥
C.④⑥
D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写及解释均正确的是
A. 0.1mol/L 的 Na2S溶液中 c(S2-)<0.1mol/L 的原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B. 实验室制备氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C. 水中加入NaOH:H2O+H2O![]() H3O++OH-加入NaOH,消耗溶液中的H3O+平衡右移
H3O++OH-加入NaOH,消耗溶液中的H3O+平衡右移
D. 在碳酸钠溶液中通入CO2气体,CO32-+H2O![]() HCO3-+OH-,CO2 消耗OH- 促使平衡正向移动
HCO3-+OH-,CO2 消耗OH- 促使平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)反应Fe(s)+CO2(g)FeO(s)+CO(g)△H1 , 平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g)△H2 , 平衡常数为K2 . 在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应 CO2(g)+H2(g)CO(g)+H2O(g)△H,平衡常数K,则△H=(用△H1和△H2表示),K=(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为;
②下列措施中能使平衡时 ![]() 增大的是(填序号)
增大的是(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母).
a.容器中压强不变 b.气体的密度不再改变c.v正(CO2)=v逆(CO) d.c(CO2)=c(CO) e.容器内气体总物质的量不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化学平衡:mA(g)+nB(g)pC(g)+qD(g).如图表示的是A的转化率与压强、温度T的关系.分析图中曲线可以得出的结论是( ) 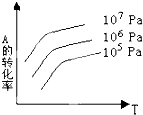
A.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q
D.正反应放热,m+n<p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,0.01molL﹣1 NaOH溶液和0.01molL﹣1的盐酸相比,下列说法正确的是( )
A.由水电离出的[H+]相等
B.由水电离出的[H+]都是1.0×10﹣12 molL﹣1
C.由水电离出的[OH﹣]都是0.01 molL﹣1
D.两者都促进了水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同质量的SO2和SO3 , 下列说法:①硫元素的质量比为5:4 ②分子数之比为5:4③原子总数之比为15:16④同温同压下的两种气体体积之比为5:4.其中正确的是( )
A.①②③④
B.①②④
C.只有③
D.其它组合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H﹣H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,根据热化学方程式H2(g)+ ![]() O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为( )
O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为( )
A.485.5 kJ/mol
B.610 kJ/mol
C.917 kJ/mol
D.1 220 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com