
【题目】在无色透明的强酸性溶液中,下列能大量共存的一组离子是( )
A. K+、Na+、NO3-、Fe2+B. K+、NH4+、OH-、Fe3+
C. K+、Na+、Br-、HCO3-D. Mg2+、Na+、Cl-、SO42-
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件或反应物的用量比改变,生成的化合物不会改变的是
A. 钠与氧气 B. 氢氧化钠与二氧化碳
C. 碳酸钠与盐酸 D. 过氧化钠与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验如图1.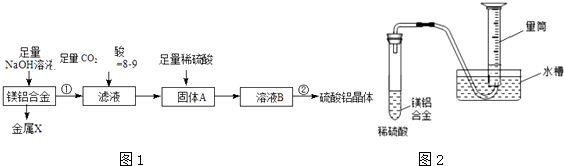
(1)写出硫酸铝在水中的电离方程式 ,
(2)镁铝合金中加NaOH溶液的离子反应方程式为 , 滤液中通入足量CO2的化学方程式
(3)操作②包含的步骤有蒸发浓缩、、过滤、干燥.
(4)金属X在CO2中燃烧的化学方程式
(5)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图2装置,则需要测定的数据(温度、压强除外)有、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性.试回答下列问题:
(1)P的原子结构示意图为;
(2)NaH2PO2为(填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 .
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4:1,则该反应的氧化产物的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮肥样品可能含有NH4HCO3,NH4Cl、NH4NO3中的一种或几种,称取该样品1.000克,溶于水配成100mL溶液、将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL 0.2mol/L的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol/L氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mL 0.15mol/L的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO3 0.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4C1
C. 原样品的含氮量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾含有大量的污染物SO2、NO.工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):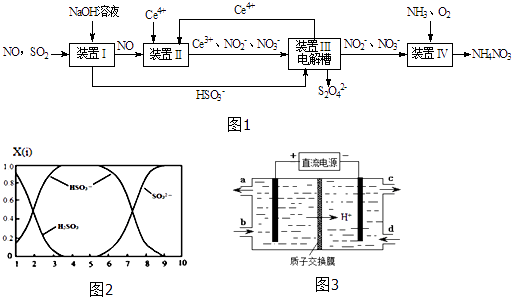
(1)装置Ⅰ中的主要离子方程式为 .
(2)含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图2所示.①若是0.1mol NaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 .
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: .
(3)写出装置Ⅱ中,酸性条件下的离子方程式 .
(4)装置Ⅲ还可以使Ce4+再生,其原理如图3所示.①生成Ce4+从电解槽的(填字母序号)口流出.
②写出与阴极的反应式 .
(5)已知进入装置Ⅳ的溶液中,NO2﹣的浓度为a gL﹣1 , 要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 需至少向装置Ⅳ中通入标准状况下的O2L.(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水蒸气,对于组成判断正确的是( )
A.一定有甲烷
B.一定有乙烯
C.一定有乙炔
D.一定有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)反应Fe(s)+CO2(g)FeO(s)+CO(g)△H1 , 平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g)△H2 , 平衡常数为K2 . 在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应 CO2(g)+H2(g)CO(g)+H2O(g)△H,平衡常数K,则△H=(用△H1和△H2表示),K=(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为;
②下列措施中能使平衡时 ![]() 增大的是(填序号)
增大的是(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母).
a.容器中压强不变 b.气体的密度不再改变c.v正(CO2)=v逆(CO) d.c(CO2)=c(CO) e.容器内气体总物质的量不变.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com