
����Ŀ��ij��ѧ��ȤС�鰴���������̽��С���þ���Ͻ��Ʊ����������塱��ʵ����ͼ1��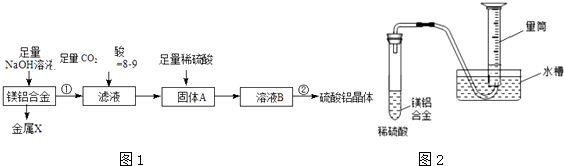
��1��д����������ˮ�еĵ��뷽��ʽ ��
��2��þ���Ͻ��м�NaOH��Һ�����ӷ�Ӧ����ʽΪ �� ��Һ��ͨ������CO2�Ļ�ѧ����ʽ
��3�������ڰ����IJ���������Ũ���������ˡ����
��4������X��CO2��ȼ�յĻ�ѧ����ʽ
��5������ȤС��Ϊ�ⶨþ���Ͻ��и���ɵ����������������ͼ2װ�ã�����Ҫ�ⶨ�����ݣ��¶ȡ�ѹǿ���⣩���� ��
���𰸡�
��1��Al2��SO4��3=2Al3++3SO ![]()
��2��2Al+2OH��+2H2O=2AlO ![]() +3H2����NaAlO2+CO2+2H2O=Al��OH��3+NaHCO3
+3H2����NaAlO2+CO2+2H2O=Al��OH��3+NaHCO3
��3����ȴ�ᾧ�����½ᾧ��
��4��2Mg+CO2 ![]() 2MgO+C
2MgO+C
��5�������������þ���Ͻ������
���������⣺þ���ܼӦ����NaOH��Һ�Ƚ�þ�����벢�õ�ƫ��������Һ������Һ�����ữ�õ������������������Ǻ��ܽ���ϡ�����У������������Һ���������ᾧ���ȵ�Ŀ������1��������Ϊǿ����ʣ���ˮ�еĵ��뷽��ʽΪAl2��SO4��3=2Al3++3SO ![]() �����Դ��ǣ�Al2��SO4��3=2Al3++3SO
�����Դ��ǣ�Al2��SO4��3=2Al3++3SO ![]() ����2����þ���Ͻ��м�����������������Һ��Al������������Һ���ɿ����Ե�ƫ�����ƣ�þ����Ӧ��������Ӧ�����ӷ���ʽΪ2Al+2OH��+2H2O=2AlO
����2����þ���Ͻ��м�����������������Һ��Al������������Һ���ɿ����Ե�ƫ�����ƣ�þ����Ӧ��������Ӧ�����ӷ���ʽΪ2Al+2OH��+2H2O=2AlO ![]() +3H2������Һ�к���NaAlO2 �� ͨ������CO2�Ļ�ѧ����ʽΪNaAlO2+CO2+2H2O=Al��OH��3+NaHCO3 �� ���Դ��ǣ�2Al+2OH��+2H2O=2AlO2��+3H2����NaAlO2+CO2+2H2O=Al��OH��3+NaHCO3����3������������IJ���������Ũ������ȴ�ᾧ�����½ᾧ��������ϴ�ӡ�������Դ��ǣ���ȴ�ᾧ�����½ᾧ������4��þ�Ͷ�����̼�ڵ�ȼ�����·�Ӧ��������þ��̼����Ӧ�Ļ�ѧ����ʽΪ2Mg+CO2
+3H2������Һ�к���NaAlO2 �� ͨ������CO2�Ļ�ѧ����ʽΪNaAlO2+CO2+2H2O=Al��OH��3+NaHCO3 �� ���Դ��ǣ�2Al+2OH��+2H2O=2AlO2��+3H2����NaAlO2+CO2+2H2O=Al��OH��3+NaHCO3����3������������IJ���������Ũ������ȴ�ᾧ�����½ᾧ��������ϴ�ӡ�������Դ��ǣ���ȴ�ᾧ�����½ᾧ������4��þ�Ͷ�����̼�ڵ�ȼ�����·�Ӧ��������þ��̼����Ӧ�Ļ�ѧ����ʽΪ2Mg+CO2 ![]() 2 MgO+C�����Դ��ǣ�2Mg+CO2
2 MgO+C�����Դ��ǣ�2Mg+CO2 ![]() 2 MgO+C����5��ij��ȤС��Ϊ�ⶨþ���Ͻ��и���ɵ���������������ͼ��֪���ܹ����������������ݽ���������֮��Ĺ�ϵʽ����֪�����ͼ1ʾװ����Ҫ�ⶨ�������������������þ���Ͻ�����������Դ��ǣ������������þ���Ͻ��������
2 MgO+C����5��ij��ȤС��Ϊ�ⶨþ���Ͻ��и���ɵ���������������ͼ��֪���ܹ����������������ݽ���������֮��Ĺ�ϵʽ����֪�����ͼ1ʾװ����Ҫ�ⶨ�������������������þ���Ͻ�����������Դ��ǣ������������þ���Ͻ��������


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������з�Ӧ���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�����
��Ӧһ��Ni(�֣�s)+4CO(g)![]() Ni(CO)4(g) ��H<0
Ni(CO)4(g) ��H<0
��Ӧ����Ni(CO)4(g)![]() Ni(����s)+4CO(g)����H>0
Ni(����s)+4CO(g)����H>0
����˵���������(����)
A. ���ڷ�Ӧһ���ʵ�����ѹǿ��������Ni(CO)4������
B. �ᴿ�����У�CO�����ѭ��ʹ��
C. �����¶ȣ���Ӧһ�ķ�Ӧ���ʼ�С����Ӧ���ķ�Ӧ��������
D. ���ڷ�Ӧ������180��200�棬�¶�Խ�ߣ�Ni(CO)4(g)��ת����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��C12H16O2��������ˮ�⡢�ữ��õ�B��C��C8H8O2����C�ĺ˴Ź������ױ������б������ұ�������2����ԭ�ӣ�B�������з�Ӧ��õ�G��G��̼���⡢������Ԫ����ɣ���Է�������Ϊ172��Ԫ�ط�����������̼55.8%������7.0%���˴Ź���������ʾֻ��һ���壮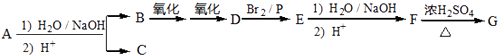
��֪�� ![]()
��ش��������⣺
��1��д��G�ķ���ʽ�� ��
��2��д��A�Ľṹ��ʽ�� ��
��3��д��F��G��Ӧ�Ļ�ѧ����ʽ�� �� �÷�Ӧ�������Ӧ���ͣ���
��4��д����������������C������ͬ���칹�壺 �� ���DZ��Ķ�λ��ȡ�������
������FeCl3��Һ������ɫ��Ӧ��
�۲�����ϩ���� ![]() ���ṹ��
���ṹ��
��5����G�Ĵֲ����У�����⺬�оۺ������ʣ�д���ۺ������ʿ��ܵĽṹ��ʽ����Ҫ��д��1�֣��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�������ͬpH��ijһԪǿ����Һ�ٺ�ijһԪ������Һ�ڷֱ���������п�۷�����Ӧ�����й������������V����ʱ�䣨t���仯��ʾ��ͼ��ȷ���ǣ� ��
A.
B.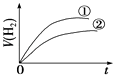
C.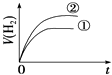
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й������ǵ������У��������( )
A.�ܼ���������Ԫ��
B.�ܷ���������Ӧ
C.���봼����������Ӧ
D.�ܱ�����ΪCO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ������ȼ�ϵ�ؽṹʾ��ͼ�����ڸõ��������ȷ���ǣ� �� 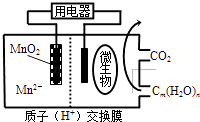
A.�������ΪCm��H2O��n������һ��������
B.�������ڵ缫���ŵ�ʱ������ԭ��Ӧ
C.�ŵ�����У�H+��������������
D.������ӦʽΪ��MnO2+4H++2e���TMn2++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����ǿ������Һ�У������ܴ��������һ��������(����)
A. K+��Na+��NO3����Fe2+B. K+��NH4+��OH����Fe3+
C. K+��Na+��Br����HCO3��D. Mg2+��Na+��Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.18 g H2O�ڱ�״���µ������22.4 L
B.22.4 L O2��һ������6.02��1023��������
C.�ڱ�״��ʱ��20 mL NH3��60 mL N2������ԭ�Ӹ�����Ϊ2��3
D.��80 g NaOH����1 Lˮ�У�������Һ��NaOH�����ʵ���Ũ��Ϊ2 moL/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݡ��ο���Ϣ���������п�ѧ��������ǡ�21���͵���Դ������δ����ʯ�͡��Ĺ۵㣮
��1���������������ȼ�յ��Ȼ�ѧ����ʽΪSi��s��+O2��g���TSiO2��s����H=��989.2kJmol��1 �� �йؼ����������±���
��ѧ�� | Si��O | O=O | Si��Si |
����kJmol��1 | x | 498.8 | 176 |
��֪1molSi�к�2molSi��Si����1molSiO2�к�4molSi��O������x��ֵΪ ��
��2���������Ϊһ���ձ�ʹ�õ�������Դ���������ã��������������ص�����˵���У�����Ϊ�������� ��
A.��������䡢���棬�Ӱ�ȫ�Ƕȿ��ǣ�������ѵ�ȼ��
B.�����Դ�ḻ�����ڿ��ɣ��ҿ�����
C.��ȼ�շų�����������ȼ�ղ���Ի�����Ⱦ�̶ȵͣ�������Ч����
D.Ѱ�Ҹ�Ч�´���������ʹ��ӦSiO2+2C ![]() Si+2CO���ڳ����·������ǹ���Դ�������õĹؼ�����
Si+2CO���ڳ����·������ǹ���Դ�������õĹؼ�����
��3����ҵ�Ʊ�����ķ�ӦΪ2H2��g��+SiCl4��g���TSi��s��+4HCl��g����H=+240.4kJmol��1 �� ���ɵ�HClͨ��100mL 1molL��1��NaOH��Һǡ����ȫ�����գ��������Ʊ�����ķ�Ӧ������������ա����ͷš���������ΪkJ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com