
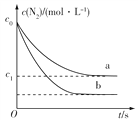
【题目】汽车尾气中NO产生的反应为N2(g)+O2(g) ![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下,N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下,N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
A. 在温度T下,该反应的平衡常数K=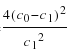
B. 在温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的反应条件改变可能是加入了催化剂
D. 若曲线b对应的反应条件改变是温度,可判断该反应的ΔH<0
【答案】A
【解析】A.N2(g)+O2(g)2NO(g),
起(mol/L) c0 c0 0
转(mol/L) c0 -c1 c0 -c1 2(c0 -c1 )
平(mol/L) c1 c1 2(c0 -c1 )
故K=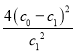 ,故A正确;B.反应前后混合气体质量不变、容器体积不变,则混合气体密度不变,故B错误;C.由图可知,b曲线氮气的平衡浓度减小,故应是平衡发生移动,催化剂只能改变速率,不能改变平衡的移动,故b曲线不可能是由于催化剂造成的,故C错误;D.由图可知,b曲线化学反应速率快(变化幅度大),氮气的平衡浓度减小,升高温度平衡正向移动,则正反应为吸热反应,即△H>0,故D错误;故选A。
,故A正确;B.反应前后混合气体质量不变、容器体积不变,则混合气体密度不变,故B错误;C.由图可知,b曲线氮气的平衡浓度减小,故应是平衡发生移动,催化剂只能改变速率,不能改变平衡的移动,故b曲线不可能是由于催化剂造成的,故C错误;D.由图可知,b曲线化学反应速率快(变化幅度大),氮气的平衡浓度减小,升高温度平衡正向移动,则正反应为吸热反应,即△H>0,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( ) 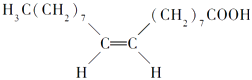
A.油酸的分子式为C18H34O2
B.油酸可与氢氧化钠溶液发生中和反应
C.1mol油酸可与2molH2发生加成反应
D.1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S ![]() Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。
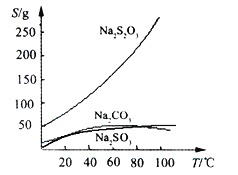

Ⅰ.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为_________________,装置6中可放入_____________________(填字母)。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④Na2SO3+S![]() Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是____________________________________(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并标定溶液的浓度:

(3)为减少产品的损失,操作①为__________,操作②是抽滤洗涤干燥,其中洗涤操作是用_______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高______________________________。
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-, 三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代酸钠溶液的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的两容器内,一个盛CH4,另一个盛NH3,若容器内温度、压强相同,则两容器内所盛气体比较,结论不正确的是
A.氢原子个数比为4∶3B.原子个数比为5∶4
C.分子个数比为1∶1D.密度比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T3℃时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液.这三种物质的溶解度随温度而变化的曲线如图.从T3降至T1 , 下列有关说法正确的是( ) 
A.T3℃时,由A物质所形成的溶液的物质的量浓度最大
B.T2℃时,由A、C两物质形成的溶液质量分数相等
C.T1℃时,由B物质所形成的溶液质量分数最大,C的最小
D.从溶解度曲线可知分离A、C的混合溶液得到A可采用蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣889.6kJ/mol.
(1)反应物能量总和_____(填“大于”、“小于”或“等于”)生成物能量总和.
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量_____889.6kJ.(填“>”、“<”或“=”)
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是_____.
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.
①已知甲烷燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,通入甲烷的这个电极是_____(填“正极”或“负极”),其另外一电极上的电极反应式为:__________________.
②通常情况下,甲烷燃料电池的能量利用率_____(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )
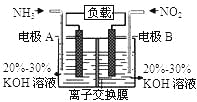
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48L NO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2×10-3mol的KZO4恰好将30mL0.1mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是
A.+2B.+3C.+4D.+6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com