
【题目】A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:

(1)分离植物油和水,选择装置______(填序号),主要使用仪器名称__________;
(2)分离乙二醇和丙三醇的混合溶液,选择装置______(填序号)。
物质 | 熔点 (摄氏度) | 沸点(摄氏度) | 密度(g/cm-3) | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比例互溶 |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液。
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):________。

Ⅱ.测定稀硫酸和稀NaOH中和热的实验装置如下图所示。

(1)写出该反应的热化学方程式(中和热ΔH=-57.3 kJ·mol-1): _______________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:

1_______________2___________________3_______________________4________________________5温度差平均值____
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种环保型塑料,其合成路线如下:

已知:①
② (R1、R2、R3、R为烃基)
(R1、R2、R3、R为烃基)
请回答下列问题:
(1)A中官能团的名称是____________,检验该官能团的试剂为___________________。
(2)反应①的化学方程式是:______________________________,其反应类型为________________,在反应①中,还可以得到另一种分子式为C10H16的化合物,其结构简式为___________________。
(3)已知,![]() 名称为丙酮酸,则C的系统命名法命名应为____________________。
名称为丙酮酸,则C的系统命名法命名应为____________________。
(4)写出反应④的化学方程式:______________________________。
(5)C的同分异构体X满足下列条件:
①常温下,与碳酸钠溶液反应放出气体;
②能发生银镜反应。则符合条件的X共有________种。其核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则X的结构简式为________________。
(6)参照E的上述合成路线,设计一条由4一甲基一3一戊酮酸为起始原料制备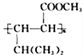 的合成路线(无机试剂任选)_________________________________________。
的合成路线(无机试剂任选)_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验编号 | 0.01molL﹣1 酸性KMnO4溶液 | 0.1molL﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学程式表示该实验的实验原理:__________________________________________________________________。
(2)实验计时方法是从溶液混合开始记时,至_________________时记时结束。
(3)V1=_____,V2=_____;设计实验Ⅰ、Ⅲ的目的是______________________________。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=________。
(5)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①________不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式:H2O ![]() H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是
A. 升高温度,KW增大,pH不变
B. 向水中加入少量硫酸,c(H+)增大,KW不变
C. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量金属Na,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x、(x=0或1),下列说法正确的是

A. 多孔碳材料电极为负极
B. 外电路电子由多孔碳材料电极流向锂电极
C. Li+向多孔碳材料区迁移
D. x=0时,正极反应式为:2Li++O2+4e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物的化学式可表示为xNa2SO4·yH2O2·zH2O,(其中x、y、z为各成分物质的量的最简整数比),其化学式可通过下列实验测定:
①准确称取1.7700g样品,配制成100mL溶液A;
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液与Na2SO4反应至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g;
③准确量取25.00mL溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液与H2O2反应,消耗KMnO4溶液0.0005mol。
H2O2与KMnO4反应的方程式如下:2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2↑+ K2SO4+8H2O
计算1.7700g样品中:
(1)Na2SO4的物质的量。_____
(2)H2O2的物质的量。______
(3)该硫酸钠-过氧化氢加合物的化学式。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式_______________________________________。

(2)已知:N2(g)+ O2(g)= 2 NO(g) △H=+180 kJ mol-1,2NO(g)+2 CO(g)= N2(g)+2 CO2(g) △H = - 746 kJmol-1,则反应CO(g) +1/2O2(g)= CO2(g)的△H=_______ kJmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是_______;电解质溶液Y是__________。
(2)银电极为电池的___极,发生的电极反应为____________; X电极上发生的电极反应为___________________。
(3)外电路中的电子是从_____电极流向_______电极。
II、如图所示,甲、乙为相互串联的两个电解池。请回答:

(1)甲池若为用电解原理精炼铜的装置,则A电极为________极,电极材料是________,电极反应为_______________________________电解质溶液可以是________________。
(2)乙池中Fe极电极反应为____________________________若在乙池中滴入少量酚酞溶液,电解一段时间后,铁极附近呈__________色。
(3)若甲池A极增重12.8 g,则乙池C(石墨)极放出气体在标准状况下的体积为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com