
 (1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是
(1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是| c(标准)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| A、氧元素的质量比为1:1 |
| B、SO2和SO3的质量比为1:1 |
| C、原子总数之比为1:1 |
| D、分子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
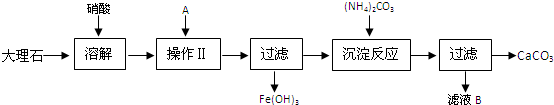
查看答案和解析>>
科目:高中化学 来源: 题型:

| t/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(LiSO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

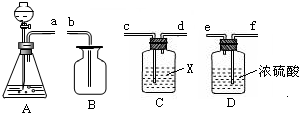
查看答案和解析>>
科目:高中化学 来源: 题型:
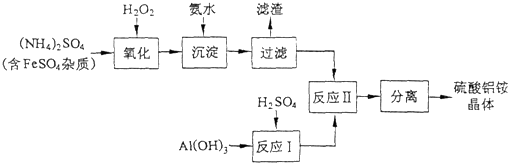
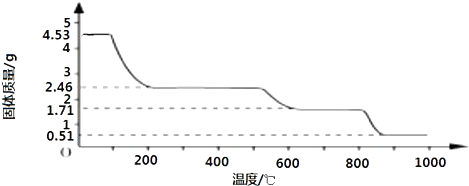
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制取乙烯时,应把无水乙醇与3mol/L的H2SO4混合均匀后迅速升温至170℃ |
| B、分馏操作中,温度计水银球应放置在蒸馏烧瓶支管口附近 |
| C、除去乙酸乙酯中乙酸杂质的方法是加入饱和NaOH溶液,充分振荡、静置后,分液 |
| D、检验溴乙烷中的湨元素的方法是加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质都难溶于水,所以需在蛋白酶的作用下水解,方可被人体吸收 |
| B、有些易溶于水的蛋白质,被人体摄入后,不需水解成氨基酸,就可被人体吸收 |
| C、在浓硫酸钠溶液中,鸡蛋白能析出,在浓盐酸中,猪肝蛋白会发生变性 |
| D、天然蛋白质水解产物都是α氨基酸,都只含1个羧基和1个氨基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com