

| t/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(LiSO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
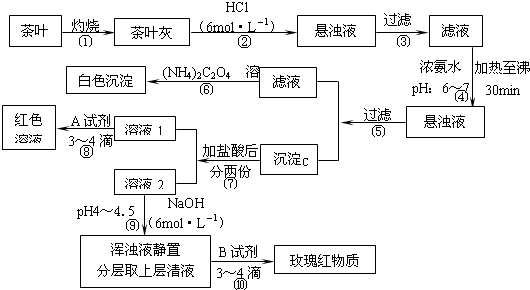
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3(CH2)3CH2OH |
| B、CH3CH2CH(CH3)CH2OH |
| C、(CH3)2CHCH2CH2OH |
| D、(CH3CH2)2CHOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
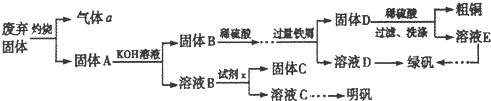
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是
(1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是查看答案和解析>>
科目:高中化学 来源: 题型:
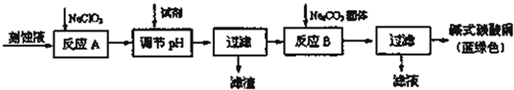
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
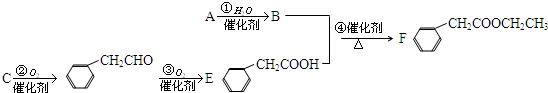
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解后未冷却至室温就移入容量瓶 |
| B、向容量瓶加水时液面低于刻度线即摇匀 |
| C、称量时间过长 |
| D、向容量瓶加水定容时眼睛俯视刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com