
【题目】I.下列物质中,不属于芳香族化合物的是_______,属于芳香烃的是________,属于苯的同系物的是___________。(填编号)

II.己知某有机物的相对分子质量为58。根据下列条件回答:
若该有机物的组成只有C、H,则此有机物的分子式为______________;若它的核磁共振氢谱只有2个峰,则它的结构简式为______________,__________________。
III.有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃。下 图中椭圆烯也属于稠环芳香烃。据此回答:

(1)己知椭圆烯(I)的分子式为C24H12,则椭圆烯(II)的分子式为_______________;
(2)上述椭圆烯的一氯取代物各有几种同分异构体:(I)有_______种,(II)有_______种;
(3)假设上述椭圆烯可以和氢气在一定条件下发生加成反应生成饱和脂环烃,则加氢后的
生成物分子中所有的碳原子是否在同一平面内:______________________。
【答案】 B CDEFG DE C4H10 CH3-CH(CH3)-CH3 CH3-CH2-CH2-CH3 C32H14 1 4 不可能都在同一平面内
【解析】I.A中含有苯环,属于芳香化合物,因为含有羟基,不属于烃;B中不含有苯环,属于脂环化合物;C中含有苯环,且只含有CH两种元素,属于芳香烃,由于含有双键,故不是苯的同系物;D中含有1个苯环,只含有CH两种元素,且支链为烷基,属于苯的同系物;E中含有1个苯环,只含有CH两种元素,且支链为烷基,属于苯的同系物;F中含有3个苯环,属于芳香族化合物,且只含有CH两种元素,属于芳香烃;G中含有2个苯环,属于芳香族化合物,且只含有CH两种元素,属于芳香烃,通过以上分析:不属于芳香族化合物的是:B; 属于芳香烃的是:CDEFG; 属于苯的同系物的是DE;
II.相对分子质量为58的烃类,我们依次推断,烷烃、烯烃,炔烃和芳香烃,很容易即可计算出为C4H10,再由其氢核磁共振光谱图有2个峰,表明该物质中的氢原子有两种,由此得出其结构简式为:CH3-CH(CH3)-CH3、CH3-CH2-CH2-CH3;
III.(1)根据Ⅱ的结构简式可知,Ⅱ的分子式中含有32个C、12个H,其分子式为:C32H12;(2)作出Ⅰ的对称轴 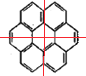 可知,其结构简式中含有3种H原则,则其一氯代物有3种;作出Ⅱ的对称轴
可知,其结构简式中含有3种H原则,则其一氯代物有3种;作出Ⅱ的对称轴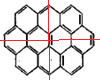 可知Ⅱ的氢原子种类为4种(如图所示),所以Ⅱ的一氯代物的数目为4;(3)假如上述椭圆烯Ⅱ可以和氢气在一定条件下发生加成反应生成饱和脂环烃,每个碳原子连有4个基团,根据甲烷的结构为正四面体可知,其加氢后的生成物分子中所有的碳原子肯定不在同一平面。
可知Ⅱ的氢原子种类为4种(如图所示),所以Ⅱ的一氯代物的数目为4;(3)假如上述椭圆烯Ⅱ可以和氢气在一定条件下发生加成反应生成饱和脂环烃,每个碳原子连有4个基团,根据甲烷的结构为正四面体可知,其加氢后的生成物分子中所有的碳原子肯定不在同一平面。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】将3.2g铜跟30mL1mol/L的硝酸充分反应,还原产物有NO和NO2,反应后的溶液中有amolH+,则此时溶液中含有NO3-的物质的量为
A. 0.5amol B. (0.1+a)mol C. 0.1amol D. 2amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(夹持装置已省略):

己知:①SO2(g)+Cl2(g)![]() SO2Cl2(I) ΔH=-97kJ/mol;
SO2Cl2(I) ΔH=-97kJ/mol;
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气
回答下列问题:
(1)装置H的名称是_______________,装置E中活性炭的作用是 _____________。
(2)请指出下列装置中应盛入的试剂:B_____________、F________________。
(3)若采用实验室制法制取Cl2,其发生装置应选择_________装置 (用A、B、C等编号填空〉,其中发生反应的离子方程式为____________________。
(4)为什么硫酰氯在潮湿空气中易“发烟”____________ (结合化学方程式说明)。
(5)为了使通入反应器的SO2和Cl2达到最佳反应比例,可观察_________(填现象)来反映通入气体的速率,利用反应液的滴加快慢对气体通入速率加以控制。
(6)该装置尚存在明显的缺陷,请指出_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 的表述不正确的是( )
的表述不正确的是( )
A. 该物质能发生缩聚反应
B. 该物质有7种不同化学环境的氢原子
C. 该物质遇FeCl3溶液显色,1 mol该物质最多能与含1 mol Br2的溴水发生取代反应
D. 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g)![]() CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是
CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是
A. v生成(CH3OH)=v消耗(CO)
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变
D. CO、H2、CH3OH的浓度比为1:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜(只允许阳离子通过)、阴离子交换膜(只允许阴离子通过)、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。下列说法正确的是

A. 阳极反应式为2H++2e-===H2↑
B. 从D口出来的是NaOH溶液
C. 阴极区pH降低
D. 当电路中通过2mol电子的电量时,会有1mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过度金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是_______,结晶得到的钼酸钠晶体时粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2![]() MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______(填序号)。
a.Ca(OH)2 b.HNO3 c.Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_________。能提高该反应速率的措施有______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式___________。
(6)已知钼酸钠溶液中c(MoO42-)=0.40molL-1,c(CO32-)=0.52molL-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的去除率为______。[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的干燥甲烷燃烧后得到49.6g CO、CO2和H2O(g)组成的气体混合物,将此气体混合物全部缓缓通过足量的浓硫酸时气体质量减少25.2g,下列说法不正确的是( )
A. 产物中水的质量为25.2g B. 参加反应的甲烷为11.2g
C. 产物中CO的物质的量为0.4mol D. 产物中n(CO)=n(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的适宜条件不包括
A. 矿石粉碎成粉末可加快反应速率 B. 原料气进入接触室之前需净化处理
C. SO2转化为SO3时用铁触媒作催化剂 D. 用98.3%的浓硫酸吸收SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com