
【题目】现有阳离子交换膜(只允许阳离子通过)、阴离子交换膜(只允许阴离子通过)、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。下列说法正确的是

A. 阳极反应式为2H++2e-===H2↑
B. 从D口出来的是NaOH溶液
C. 阴极区pH降低
D. 当电路中通过2mol电子的电量时,会有1mol的O2生成
科目:高中化学 来源: 题型:
【题目】镇痉药物C、化合物N以及高分子树脂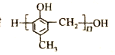 的合成路线如下:
的合成路线如下:

(1)A的化学名称为_____,A在催化剂作用下可与H2反应生成B,B的式量为108,B的结构简式为_____。
(2)C中官能团的名称为_____,C在碱性条件下水解的化学反应方程式为_____。
(3)A与银氨溶液反应的化学方程式为_________。
(4)F与甲醛合成高分子树脂的反应类型为_________,N的结构简式为________。
(5)扁桃酸的一种同分异构体满足下列条件:
①遇FeCl3溶液不发生显色反应
②能发生银镜反应,在酸性条件下水解产物之一能与FeCl3溶液发生显色反应
③分子中有5种不同化学环境的氢,核磁共振氢谱峰面积之比为:1:2:2:1.
写出该同分异构体的结构简式________。
(6)写出用乙醇为原料制备化合物CH3COCl的合成路线_________。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)写出氯化钠的电子式_______________,氮气的结构式______________;
(2)用离子方程式表示氨水溶液显碱性的原因_________________;
用离子方程式表示碳酸钠溶液显碱性的原因_____________________;
(3)某碳氢化合物的相对分子质量为72,且一个分子结构中有3个甲基,则该有机物的结构简式为____________,该有机物的系统命名是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+ 5O2==4NO + 6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A. 4v(NH3)=5v(O2) B. 6v(O2)= 5v(H2O) C. 6v(NH3)=4v(H2O) D. 5v(O2)= 4v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质中,不属于芳香族化合物的是_______,属于芳香烃的是________,属于苯的同系物的是___________。(填编号)

II.己知某有机物的相对分子质量为58。根据下列条件回答:
若该有机物的组成只有C、H,则此有机物的分子式为______________;若它的核磁共振氢谱只有2个峰,则它的结构简式为______________,__________________。
III.有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃。下 图中椭圆烯也属于稠环芳香烃。据此回答:

(1)己知椭圆烯(I)的分子式为C24H12,则椭圆烯(II)的分子式为_______________;
(2)上述椭圆烯的一氯取代物各有几种同分异构体:(I)有_______种,(II)有_______种;
(3)假设上述椭圆烯可以和氢气在一定条件下发生加成反应生成饱和脂环烃,则加氢后的
生成物分子中所有的碳原子是否在同一平面内:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(OHC-COOH)是合成名贵香料的原料之一。
I.由乙二醛催化氧化制乙醛酸的反应如下:2OHC-CHO(g)+O2(g) ![]() 2OHC-COOH(g)△H
2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表1:
化学键 | O=O | C-O | O-H | C-H |
键能(KJ/mol) | 498 | 351 | 465 | 413 |
计算上述反应的△H=____________kJ·mol-1。
(2)一定条件下,按照![]() 投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。
投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。

①该反应在A点放出的热量________B点放出的热量(填“>”、“=”或“<”)
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由__________。
③图中A点时,乙醛酸的体积分数为_____________。
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有__________ (列举一条)。
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图所示。
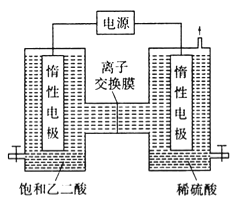
(1)图中的离子交换膜为___________ (填“阳”或“阴”)膜。
(2)稀硫酸的作用为____________。
(3)生成乙醛酸的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
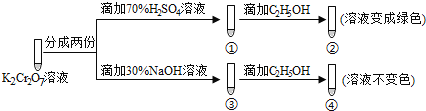
结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某恒容密闭容器内有可逆反应:A(g)+3B(g)![]() 2C(g),该反应进行到一定限度后达到化学平衡的标志是( )
2C(g),该反应进行到一定限度后达到化学平衡的标志是( )
A. 3v正(A)=v逆(B)
B. 容器内气体的质量不随时间而改变
C. 容器内A、B、C三种物质的浓度相等
D. 容器内A、B、C的物质的量之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属钙置于空气中充分燃烧,然后向所得固体产物中加入一定量蒸馏水,观察到剧烈反应,产生大量的热,并且放出有臭味的气体。对此,化学兴趣小组的同学们在老师的指导下进行了探究。
【査阅资料】①Mg在氮气中燃烧生成氮化镁(Mg3N2),氮化镁与水发生复分解反应,有NH3生成。
②CaO2遇水反应生成H2O2,H2O2会分解产生一定量的O3。
③碘量法是最常用的臭氧测定方法,其原理为:O3+2KI+H2O=O2+I2+2K0H
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性,因此可以推断Ca在空气燃烧时,能与空气中的氮气反应生成________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧也有CaO2生成,其化学方程式为:________。
(3)丙同学对臭味气体的成分提出三种假设。
【提出假设】假设1:产生臭味的气体只是O3;
假设2:产生臭味的气体只是_______________;
假设3:产生臭味的气体是____________________。
【实验探究】为此,同学们对臭味气体的成分进行了实验探究。实验室提供的实验试剂有:红色石蕊试纸、蓝色石蕊试纸、淀粉-KI试纸、蒸馏水。
请按下列表格填写完成实验操作、与结论相应的预期现象:
实验操作 | 预期现象 | 结论 |
取少量钙在空气中充分燃烧后的 固体产物于试管中,加少量蒸熘水,分别用________、________在短时间内快速检测产生的气体。 | __________ | 假设1成立 |
__________ | 假设2成立 | |
_________ | 假设3成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com