
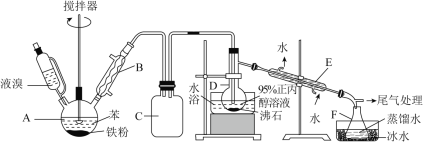
【题目】溴苯和1-溴丙烷是重要的医药中间体。某化学兴趣小组设计如下方案制得两种有机物,实验步骤如下:
I.连接装置后,检査气密性。向各容器中加入一定量的药品。
II.将液溴滴入装置A中,保持75℃水浴加热装置C10min。
III.反应完毕后,将装置F馏出液分离,得1-溴丙烷的粗产品。
IV.将分出的粗产品,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,进一步提纯得1-溴丙烷。
有关数据如下:
苯 | 溴 | 溴苯 | 1-溴丙烷 | 正丙醇 | |
密度/gcm-3 | 0.88 | 3.10 | 1.50 | 1.36 | 0.8 |
沸点/℃ | 80 | 59 | 156 | 71 | 97.1 |
水中溶解度 | 难溶 | 难溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)写出装置A中发生反应的方程式:________。
(2)装置B的作用________。
(3)步骤IV中第一步水洗的目的主要是________。
(4)制得的溴苯中含有少量的苯,提纯溴苯的实验操作名称________。
(5)从锥形瓶内分离出1-溴丙烷粗产品,所采用的操作名称是________![]() 检验1-溴丙烷中的溴原子,需加入的试剂
检验1-溴丙烷中的溴原子,需加入的试剂![]() 按照先后顺序写
按照先后顺序写![]() ________。
________。
【答案】![]() +Br2
+Br2![]()
![]() +HBr↑ 导气、冷凝、回流 除去正丙醇 蒸馏 分液 氢氧化钠溶液,稀硝酸,硝酸银溶液
+HBr↑ 导气、冷凝、回流 除去正丙醇 蒸馏 分液 氢氧化钠溶液,稀硝酸,硝酸银溶液
【解析】
溴苯可通过苯与液溴在铁粉的催化下发生反应制备,因此A装置是制取溴苯的装置;由于制备溴苯的同时也生成了HBr,HBr可以随气流流入装置D中,从而与D中的正丙醇发生反应生成1-溴丙烷;根据题中提供的表格可知,苯和液溴的沸点相比于溴苯较低,因此为了避免其损耗,可通过B即球形冷凝管对A中逸出的气体进行冷凝回流;同样根据表格可知,1-溴丙烷与正丙醇沸点相差不大,因此经过冷凝后获得馏分中会含有较多的正丙醇杂质,务必要将其除净才能获得较为纯净的1-溴丙烷产品。
(1)通过分析可知,A中发生的反应的方程式为:![]() +Br2
+Br2![]()
![]() +HBr↑;
+HBr↑;
(2)通过分析可知,装置B在制备溴苯时起到了冷凝回流和导气的作用;
(3)通过分析可知,制备1-溴丙烷时,经过E装置对产物气体冷凝后获得馏分中会含有较多的正丙醇杂质,考虑到正丙醇易溶于水,所以步骤Ⅳ中先用水洗目的是除去杂质正丙醇;
(4)溴苯和苯会相互溶解,考虑到二者沸点相差明显,因此分离提纯溴苯时,可采用蒸馏的方法;
(5)通过分析可知,锥形瓶中主要有水,正丙醇以及1-溴丙烷,所以会产生分层的现象,因此分离1-溴丙烷粗品时可采用分液的方法;检验卤代烃中卤素原子,一般都是先加入NaOH水溶液使其发生水解反应,从而将卤素原子转化为卤素离子;再加入硝酸酸化,最后加入硝酸银溶液,观察沉淀的颜色从而确定卤素原子的种类。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国科学家团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
(1)基态N原子的价电子占据的能量最高的能级是___,价电子在该能级上的排布遵循的原则是__。
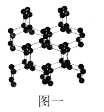
(2)除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等物质。而高聚氮结构具有空间网状结构,如图一所示,则N70的沸点___![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 高聚氮的沸点,原因是___;
高聚氮的沸点,原因是___;
(3)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。与全氮阴离子互为等电子体的一种非极性分子的结构式为___。叠氮化物能形成多种配合物,在[CO(N3)(NH3)5]SO4,其中钴原子的配体是___,SO42-的立体构型为___。
(4)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO3
B.N2H4分子中N原子均采取sp3杂化
C.NaN3的晶格能大于KN3的晶格能
D.纯叠氮酸HN3在常温下是一种液体,是因为分子中存在一种特殊的化学键-氢键
(5)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V形,每个氮原子均达到8电子稳定结构,则阳离子的电子式为___。
(6)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
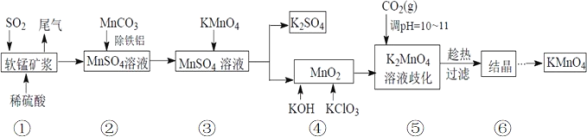
【题目】高锰酸钾是中学化学中常用的强氧化剂。某化学研究小组用软锰矿(主要成分为MnO2另含有少量铁、铝等金属的化合物)吸收燃煤尾气中的SO2,并制取MnO2和K2SO4,而后又用MnO2 制取KMnO4。设计生产流程如下:请回答下列问题:
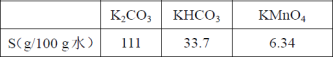
 20℃时,相关物质的溶解度数据见下表:
20℃时,相关物质的溶解度数据见下表:
(1)若将SO2气体通入下列溶液中,溶液不会褪色的是___。
A.紫色石蕊试液 B.品红溶液 C.新制氯水 D.酸性高锰酸钾溶液
(2)用 MnCO3 除去液体中的 Fe3+时发生的离子方程式__________。
(3)步骤④中应在______中熔化;
A.瓷坩埚 B.铁坩埚 C.石英坩埚 D.蒸发皿
当溶液调 pH达10~11时,停止通入 CO2。若 CO2过多,会造成的后果是:______。
(4)在此生产流程中,可循环使用的物质是(填名称)________。
步骤⑤中发生反应的化学方程式为_________;
步骤⑤之后,趁热过滤的理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
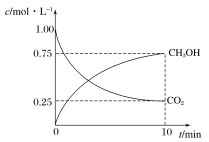
(1)该反应的平衡常数K表达式为________。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_______,H2的转化率为_______。
(3)下列叙述中,能说明反应已达到化学平衡状态的是________(填字母)。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1∶3∶1∶1
B.v正(CO2)∶v逆(H2)=1∶3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1452.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式:____________________________________________
能说明醋酸是弱电解质的事实是_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
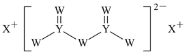
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱铁矿(主要成分是碳酸亚铁FeCO3)为原料制取铁的流程如图:

(1)“浸取”时通常将菱铁矿石进行粉碎,其目的是__________(填“加快”或“减慢”)反应速率,写出浸取过程中的化学反应方程式:____________________________。
(2)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则操作①的名称为____________(填“蒸发”或“过滤”)。
(3)利用金属活动性的不同,可以采取不同的冶炼方法,其中上述过程中的②属于______(填“热还原法”或“电解法”)。
(4)氨水由氨气溶于水制备,工业合成氨气反应方程式为:N2+3H2![]() 2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3 ,用NH3表示该反应的速率v(NH3)=_____________molL-1min-1。
2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3 ,用NH3表示该反应的速率v(NH3)=_____________molL-1min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0 mol·L-1的浓硫酸稀释成1.80 mol·L-1的稀硫酸100 mL,实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用量筒量取________ mL的18.0 mol·L-1的浓硫酸;
②将__________沿烧杯内壁慢慢注入盛有少量__________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入________ mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线__________处;
⑥改用__________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(2)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__________;
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】600℃时,在 2 L 的恒容密闭容器中充入一定量的 CO 和 H2O,发生反应: CO (g)+H2O (g) ![]() CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:
CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:

下列说法正确的是
A.0~5 min 用 CO 表示的平均反应速率为 0.08mol·L1·min1
B.该反应在 10 min 后才达到平衡
C.温度升高至 800℃时,反应平衡常数为 0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,达到平衡时 n(CO2)=0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com