
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液 (二甲胺在水中的电离与氨相似,在常温下Kb[(CH3)2NH·H2O]=1.6×10-4 )。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. D点溶液中:2c(Na+)=3c(Cl-)
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. 曲线②代表滴定二甲胺溶液的曲线
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点
【答案】B
【解析】曲线②电导率先减小后增大,曲线②表示用0.100 mol·L-1盐酸滴定10.00 mL浓度为0.100 mol·L-1的NaOH;曲线①电导率持续增大,曲线①表示用0.100 mol·L-1盐酸滴定10.00 mL浓度为0.100 mol·L-1的二甲胺溶液;D点溶液表示盐酸、氢氧化钠3:2混合,根据物料守恒3c(Na+)=2c(Cl-),故A错误;A点溶液盐酸与二甲胺1:1混合,根据质子守恒:c(H+)=c(OH-)+c[(CH3)2NH·H2O],故B正确;曲线①代表滴定二甲胺溶液的曲线,故C错误;C点溶质是氯化钠、B、D点都有剩余的盐酸,抑制水电离、A点是强酸弱碱盐溶液,水解促进水电离,所以水的电离程度最大的是A点,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有甲、乙两种成分: ![]()
(1)①用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键,方案是否可行(填“可 行”或“不可行”).
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式 .
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物): 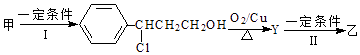
步骤Ⅰ的反应类型为 , Y的结构简式 , 设计步骤Ⅰ的目的是 .
(3)1mol乙最多可与 mol H2发生加成反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品,试根据图回答有关问题: 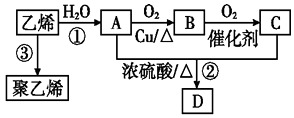
已知:有机物D是一种有水果香味的油状液体.
(1)有机物B的名称为 , 结构简式为 . 决定有机物A、C的化学特性的原子团的名称分别是 .
(2)写出图示反应②、③的化学方程式,并指明反应类型: ②; 反应类型: .
③; 反应类型: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000molL ﹣1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 .
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的
B.某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强
C.H2CO3的电离常数表达式:K= ![]()
D.电离平衡常数可以表示弱电解质的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示装置进行原电池原理的探究,下列叙述错误的是( )

A. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________。

(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)= ____________。
③下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________(保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
【答案】 略 略 略 略 略 略 略 略
【解析】(1). 由图1可知,As2O3(s)和O2(g)反应转化为As2O5(s)的△H=-(914.6-619.2)kJ/mol=-295.4kJ/mol,则热化学方程式为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol,故答案为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol;
(2). ①. 升高温变,溶液中AsO43-的平衡转化率减小,说明升高温度,平衡逆向移动,该反应为放热反应,则△H<0,故答案为:小于;
②. 在0~10min 内,I2的浓度从0变为0.015mol/L,由反应方程式可知,I-减少了0.03mol/L,则0~10min内,用I-表示的反应速率v(I-)=0.03mol/L÷10min=0.003mol/(L·min),故答案为:0.003mol/(L·min);
③. a. 根据物料守恒关系可知,溶液中的c(AsO33-)+c(AsO43-)始终不变,所以c(AsO33-)+c(AsO43-)不再变化,不能说明反应达到平衡状态,故a错误;b. 溶液颜色不再变化,说明各物质的浓度不再改变,反应达到平衡状态,故b正确;c. c(AsO33-)与c(AsO43-)的比值不再变化,说明正逆反应速率相等,反应达到平衡状态,故c正确;d. I-的生成速率等于I2的生成速率,正逆反应速率不相等,说明反应没有达到平衡状态,故d错误;答案选:bc;
④. 由反应方程式可知,在该条件下,反应平衡常数的表达式K=![]() ,故答案为:
,故答案为:![]() ;
;
(3). ①. 用0.02500mol/L的I2溶液滴定含AsO33-和AsO43-的混合溶液,当滴入最后一滴标准液时,溶液由无色变蓝色,且30s内不恢复,即为滴定终点,上述混合液用0.02500mol/L的I2溶液滴定,重复滴定3次,平均消耗I2溶液40.0mL,根据As2O5+6OH=2AsO43+3H2O、AsO33-+I2+H2O ![]() AsO43-+2I-+2H+可知:
AsO43-+2I-+2H+可知:
1 1
n 0.02500mol/L×0.04L,n(AsO33-)= 0.001mol,则试样中As2O5的质量分数是![]() ×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
【题型】综合题
结束】
11
【题目】元素周期表中第四周期元素有许多重要用途。
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com