
【题目】常见的氮肥有________________、_______________。
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1molL﹣1的氨水.请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”、“减小”或“不变”).
(填“增大”、“减小”或“不变”).
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:;所得溶液的pH7(填“<”、“=”或“>”),用离子方程式表示其原因 .
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时 ![]() =a molL﹣1 ,
=a molL﹣1 , ![]() 则= .
则= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液 (二甲胺在水中的电离与氨相似,在常温下Kb[(CH3)2NH·H2O]=1.6×10-4 )。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. D点溶液中:2c(Na+)=3c(Cl-)
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. 曲线②代表滴定二甲胺溶液的曲线
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2的燃烧热是akJ/mol,由H2、CO按3:1比例组成的混合物2mol,完全燃烧并恢复到常温吋,放出的热量为bkJ,则CO的燃烧热为(kJ/mol)为( )
A.2b﹣3a
B.3a﹣2b
C.![]() (2b﹣3a)
(2b﹣3a)
D.![]() (a﹣2b)
(a﹣2b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:

已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;

回答下列问题:
(1)A的化学名称为____________。
(2)G的结构简式为________________,G中的含氧官能团是________________。(填官能团名称)
(3)由B生成C的反应类型为_______________,由C生成D的反应类型为_____________。
(4)由E生成F的化学方程式为________________________________。
(5)H的同分异构体中,含有酯基,能发生银镜反应、核磁共振氢谱之比是1:1:3的同分异构体结构简式_____________________________________________。(写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素全部是微量元素的是 ( )
A. Na 、K、Cl、S、O B. Fe、Zn、Cu、B
C. N、H、P、C D. Ge、CA、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( ) 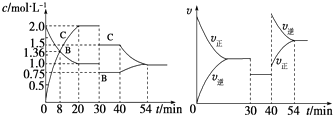
A.8 min时表示正反应速率等于逆反应速率
B.前20 min A的反应速率为0.05 molL﹣1min﹣1
C.反应方程式中的x=1,30 min时表示增大压强
D.40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe2+的核外电子排布式为[Ar]______,有__个未成对电子。
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是_____。
(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因________。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是____;SiO2中Si原子采取____杂化。
(5)一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是___,与溴紧邻的溴原子数目是________,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为________;已知晶胞参数为apm,其密度为_______g/cm3 (列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com