
【题目】已知B是酒的主要成分、C是食醋的主要成分。下图是相关有机物的转换关系:
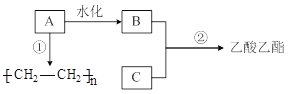
完成下列填空。
(1)A的结构简式为______,工业上生产A所需的矿物资源是______。
(2)请写出C的官能团名称___________。
(3)反应②的化学方程式为_____________。
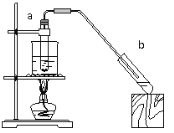
(4)实验室用如图装置制取乙酸乙酯。实验时需预先在用于收集乙酸乙酯的试管b中加入_____溶液。实验结束后,发现试管b中的液体分两层,乙酸乙酯在____层(填“上”或“下”),分离乙酸乙酯的实验操作方法是_______。
【答案】CH2=CH2 石油 羧基 CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O 饱和碳酸钠 上 分液
CH3COOCH2CH3+H2O 饱和碳酸钠 上 分液
【解析】
B是酒的主要成分、C是食醋的主要成分,则B为CH3CH2OH、C为CH3COOH,B与C反应生成CH3COOC2H5,A水化得到乙醇,则A为 CH2=CH2;
(1)A为乙烯,乙烯是衡量石油化工发展水平的标志;
(2)C为乙酸;
(3)反应②是乙酸乙醇在浓硫酸催化作用下生成乙酸乙酯;
(4)为了除去乙酸乙酯中的杂质,一般把乙酸乙酯蒸汽通入饱和碳酸钠溶液;乙酸乙酯的密度比水小;
B是酒的主要成分、C是食醋的主要成分,则B为CH3CH2OH、C为 CH3COOH,B与C反应生成CH3COOC2H5,A水化得到乙醇,则A为 CH2=CH2;
(1)A为乙烯,其结构简式为CH2=CH2,工业上生产乙烯主要是通过对石油分馏产品的裂解得到;
(2)C为乙酸,含有的官能团为羧基;
(3)反应②是乙酸乙醇在浓硫酸催化作用下生成乙酸乙酯,其反应方程式为CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)为了除去乙酸乙酯中的杂质乙酸和乙醇,一般要把乙酸乙酯蒸汽通入饱和碳酸钠溶液中;乙酸乙酯的密度比水小,则乙酸乙酯在上层,水溶液在下层;分离互不相溶的液体混合物应选择分液操作。


科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)一氯胺(NH2Cl)是饮用水的二级消毒剂,水解生成一种具有强烈杀菌消毒作用的物质:
①NH2Cl中Cl元素的化合价为_____________。
②NH2Cl发生水解反应的化学方程式为_____________________________。
(2)SO2和CO均为燃煤产生的烟道气中有害成分,在催化作用下可利用二者相互反应进行无害化处理并回收硫。有关资料如图1所示。则:
①常温常压下,质量均为11.2g的CO(g)和S(s)分别完全燃烧生成CO2(g)或SO2(g),放出的热量前者比后者多________kJ。
②SO2(g)+2CO(g)=S(s)+2CO2(g) △H=___________________.
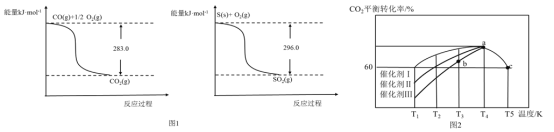
(3)在一定条件下,向恒容密闭容器中充入1.0molCO2和3.0molH2,在一定温度范围内发生如下转化:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-xkJ/mol x>0)。在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图2所示:
①催化效果最佳的是催化剂__________(选填“I”、“Ⅱ”或“Ⅲ”);b点v(正)___v(逆)(选填“>”、“<”或“=”)
②此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是_____________
(4)常温下,H2CO3的电离常数为:Ka1=4×10-7,Ka2=4×10-11。已知0.1mol/LNH4HCO3溶液的pH=8,则在此溶液中:
①下列有关离子浓度的关系式中,不正确的是_____(填序号)
A.c(NH4+)>c(HCO3-)>c(OH-)>c(H+)
B.c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(H2CO3)
C.c(H2CO3)-c(CO32-)-c(NH3·H2O)=9.9×10-7mol·L-1
②![]() =________(结果保留三位有效数字)。
=________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨对人类生存贡献巨大,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__。
(2)平衡后,若提高H2的转化率,可以采取的措施有__。
A.加入催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中的部分微粒)。
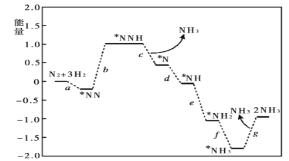
写出步骤c的化学方程式___;由图像可知合成氨反应的△H__0(填“>”“<”或“=”)。
(4)将n(N2)∶n(H2)=1∶3的混合气体,匀速通过装有催化剂的刚性反应器,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图。随着反应器温度升高,NH3的体积分数φ(NH3)先增大后减小的原因是_。
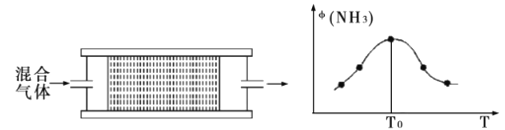
某温度下,混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则H2的转化率为___(气体分压P分=P总×体积分数)。用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作KP),此温度下,该反应的化学平衡常数KP=__(分压列计算式、不化简)。
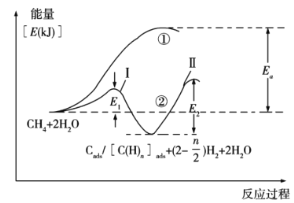
(5)合成氨的原料气H2可来自甲烷水蒸气催化重整(SMR)。我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2-![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/C(H)n]ads+2H2O→CO2+(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/C(H)n]ads+2H2O→CO2+(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①__②(填“>”“<”或“=”);控制整个过程②反应速率的是第__步(填“I”或“II”),其原因为__。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①__②(填“>”“<”或“=”);控制整个过程②反应速率的是第__步(填“I”或“II”),其原因为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间的反应既属于氧化还原反应,又属于离子反应的是( )
A. NaCl溶液与AgNO3溶液 B. Zn与稀H2SO4
C. H2与O2 D. Na2O与H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A. SO2是直线形分子B. SO3是三角锥形分子
C. BF3的键角为120°D. PCl3是平面三角形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照① ⑥在表中的位置,用化学用语回答下列问题。

(1)元素①的原子结构示意图为_____
(2)元素②、③形成离子的半径_____>_____。
(3)元素⑤、⑥形成的气态氢化物稳定性__________>___________。
(4)元素④的最高价氧化物的水化物与元素③的最高价氧化物的水化物稀溶液反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3可作食用碱。下列方程式中正确的是( )
A.Na2O2与CO2反应生成Na2CO3:Na2O2 +CO2=Na2CO3+O2
B.Na2CO3溶液呈碱性:CO32-+H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.NaHCO3可作发酵粉:2NaHCO3![]() Na2CO3+CO2↑ +H2O
Na2CO3+CO2↑ +H2O
D.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com