
【题目】下表为元素周期表的一部分,请参照① ⑥在表中的位置,用化学用语回答下列问题。

(1)元素①的原子结构示意图为_____
(2)元素②、③形成离子的半径_____>_____。
(3)元素⑤、⑥形成的气态氢化物稳定性__________>___________。
(4)元素④的最高价氧化物的水化物与元素③的最高价氧化物的水化物稀溶液反应的离子方程式为_____。
【答案】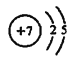 F- Na+ HCl H2S Al(OH)3 + OH-=[Al(OH)4]-
F- Na+ HCl H2S Al(OH)3 + OH-=[Al(OH)4]-
【解析】
根据元素在周期表中的相对位置首先判断出元素名称,然后结合元素周期律分析解答。
根据元素在周期表中的位置可知①~⑥分别是N、F、Na、Al、S、Cl。则
(1)元素①是氮元素,原子结构示意图为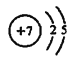 ;
;
(2)核外电子排布相同时离子半径随原子序数的增大而减小,则元素②、③形成离子的半径大小顺序是F->Na+;
(3)同周期自左向右非金属性逐渐增强,非金属性越强,氢化物越稳定,则元素⑤、⑥形成的气态氢化物稳定性是HCl>H2S;
(4)元素④的最高价氧化物的水化物是氢氧化铝,与元素③的最高价氧化物的水化物稀溶液氢氧化钠反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,W单质的熔沸点最高
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知B是酒的主要成分、C是食醋的主要成分。下图是相关有机物的转换关系:
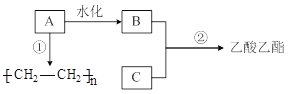
完成下列填空。
(1)A的结构简式为______,工业上生产A所需的矿物资源是______。
(2)请写出C的官能团名称___________。
(3)反应②的化学方程式为_____________。
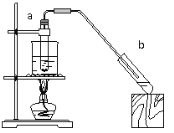
(4)实验室用如图装置制取乙酸乙酯。实验时需预先在用于收集乙酸乙酯的试管b中加入_____溶液。实验结束后,发现试管b中的液体分两层,乙酸乙酯在____层(填“上”或“下”),分离乙酸乙酯的实验操作方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁:装置如图所示。
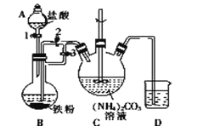
(1)B中可观察到的现象是铁粉逐渐溶解,_________________________。
将B中生成的FeCl2溶液压入装置C的操作是______________________。
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(2)加入少量铁粉的作用是___________________,反应后加入适量乳酸的作用是________________。
(3)从所得溶液中获得乳酸亚铁晶体所需的实验操作是______ _、______、洗涤、干燥。
(4)设计实验证明乳酸亚铁中含Fe2+ ____________________ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列化学用语的理解和描述均正确的是
A. 电子式![]() 可以表示羟基.也可以表示氢氧根离子
可以表示羟基.也可以表示氢氧根离子
B. 填充模型![]() 可以表示二氧化碳分子,也可以表示水分子
可以表示二氧化碳分子,也可以表示水分子
C. 原子结构示意图![]() 可以表示12C,也可以表示14C
可以表示12C,也可以表示14C
D. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
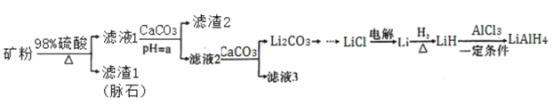
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________、加热;加入CaCO3的作用是_____,“a”的最小值为______________。
(2)写出LiH和AlC13反应的化学方程式为_____________(条件不作要求)。
(3)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是_______________。
(4)四氢铝锂LiAlH4溶解于NaOH溶液后得到无色透明溶液,并产生一种无色气体。请写出该反应的离子方程式_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为________________(结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物的说法不正确的是

A. 该有机物的分子式为C15H18O4
B. 1 mol该化合物最多可以与2 mol NaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可与FeCl3溶液发生显色反应,又可与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com