
| m |
| M |
| n |
| V |
| N |
| NA |
| 20g |
| 40g/mol |
| 0.5mol |
| 0.5L |
| 1mol/L×1mL |
| 100mL |
| 9.03×1023 |
| 6.02×1023mol-1 |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、1mol氧 |
| B、1mol任何物质的质量都等于该物质的相对分子质量 |
| C、1molHCl气体的体积等于22.4L |
| D、氧气的摩尔质量为32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两负电荷 | 0 |
| 丁 |
| 反应① |
| 丁 |
| 反应② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
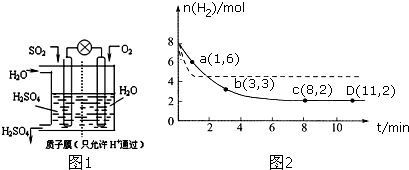
查看答案和解析>>
科目:高中化学 来源: 题型:
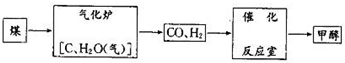
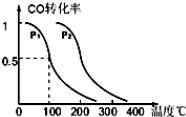
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com