
金属M与AgNO3溶液发生反应:M+2AgNO3=M(NO3)2+2Ag,下列说法正确的是
A. M可能是铝
B. Ag的金属活动性比M强
C. 反应前后M的化合价发生了改变
D. 在金属活动性顺序里,M一定排在氢前
科目:高中化学 来源:2015-2016学年浙江余姚中学高二上学期期中考试化学试卷(解析版) 题型:选择题
以葡萄糖为燃料的微生物燃料电池如图所示。关于该电池的叙述正确的是:
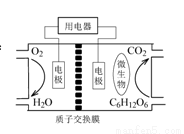
A.该电池能够在高温下工作
B.放电过程中H+从正极区向负极区迁移
C.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
D.在电池反应中,每消耗1mol氧气,理论上能生成CO222.4L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北冀州市高一上第四次月考化学试卷(解析版) 题型:选择题
下列各项操作中,不会发生“先产生沉淀,然后沉淀又溶解”现象的是( )
① 向饱和碳酸钠溶液中通入过量的CO2 ;
② 向NaAlO2溶液中逐滴加入过量的稀盐酸,
③ 向AlC13溶液中逐滴加入过量的稀氢氧化钠溶液;
④向硝酸银溶液中逐滴加入过量的盐酸
A.①② B.①④ C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东湛江第一中学高二上第二次考试化学卷(解析版) 题型:填空题
1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
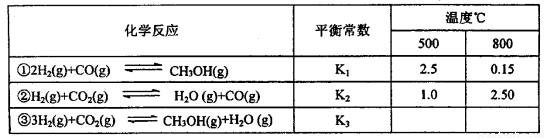
(1)反应②是____________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P的关系如右图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。

据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示)。
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右图所示,

若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上期中测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法中正确的有
A.标准状况下,22.4L H2O含分子数为NA
B.1 mol/L的CaCl2溶液中含Cl-的数目为2 NA
C.常温常压下,17g NH3含电子数目为10NA
D.2.7 g金属铝变成铝离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第一次月考化学试卷(解析版) 题型:填空题
(1)常温常压下,等质量的NO2和N2O4,二者的物质的量之比为________,原子个数之比为________,密度之比为_______。
(2) CO2气体在标准状况下的密度为_________g/L。
(3) 氢气是一种清洁的可再生能源。某氢氧燃料电池(氢气和氧气反应生成水)轿车,每行驶100 km仅耗氢气1 kg左右,同时消耗氧气的物质的量约为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二上期中测试化学试卷(解析版) 题型:选择题
白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有 关数据估算该反应的ΔH,其中正确的是
关数据估算该反应的ΔH,其中正确的是
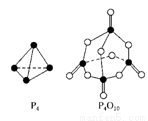
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第一次月考化学试卷(解析版) 题型:填空题
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图;请写出NO2和CO反应的热化学方程式____________。
(2)在固定体积的密闭容器中,进行如下化学反应3A(s)+4B(g) 4C(g) △H>0 ,其平衡常数K与温度T的关系如下表:
4C(g) △H>0 ,其平衡常数K与温度T的关系如下表:

①该反应的平衡常数表达式: K=________________。
②试判断K1____________K2(填写“>”,“=”或“<”)。
③下列各项能说明该反应已达到平衡状态的是 ___________ (填字母)。
a.容器内B、C的浓度之比为1︰1
b.v(B)正=v(C)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是____________。
2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是____________。
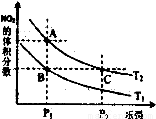
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在l L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=___________,以NH3表示该过程的反应速率v(NH3)=______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省宁德市高二上期中(文)化学试卷(解析版) 题型:选择题
下列化合物中,既有离子键又有共价键的是
A.H2O B.NaCl C.NaOH D.HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com