
【题目】亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲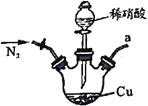 乙
乙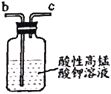 丙
丙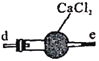 丁
丁![]()
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
【答案】B
【解析】
A.甲中稀硝酸与铜反应生成一氧化氮,一氧化氮易被空气中的氧气氧化,需要将装置中的空气全部排尽,空气中有少量二氧化碳,也会和过氧化钠反应,否则丁装置中无法制得亚硝酸钠,则滴入稀硝酸前需通人N2排空气,故A正确;
B.制取的一氧化氮含有水蒸气,过氧化钠可与水反应,导致制取产物不纯,可用氯化钙吸收水蒸气,一氧化氮有毒,不能排放的大气中,可用高锰酸钾溶液吸收,则仪器的连接顺序为a-d-e-f-g-b或a-d-e-g-f-b,故B错误;
C.根据B选项分析,制取的一氧化氮含有水蒸气,过氧化钠可与水反应,导致制取产物不纯,可用氯化钙吸收水蒸气,故丙中CaCl2用于干燥NO,故C正确;
D.根据已知信息:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+,则乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O,故D正确;
答案选B。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如图所示。下列说法不正确的是
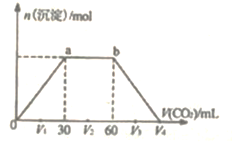
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. oa过程是CO2与Ba(OH)2反应生成BaCO3的过程
D. 原混合物中 n[Ba(OH)2]:n(NaOH)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①HCl气体 ②Cu ③蔗糖 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氯酸钾溶液 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)属于电解质的是___;属于非电解质的是___。
(2)②和⑧反应的化学方程式为:3Cu +8HNO3=3Cu(NO3)2+2NO↑+4H2O
上述反应中氧化产物是___。硝酸没有全部参加氧化还原反应,参加氧化还原反应的硝酸占总硝酸的___。用双线桥法分析上述反应(只需标出电子得失的方向和数目)___。3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(4)⑨在水中的电离方程式为___,
(5)34.2g⑨溶于水配成1000mL溶液,SO42-的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L
②0.5 mol H2所占体积为11.2 L
③标准状况下,1 mol H2O的体积为22.4 L
④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L
⑤各种气体的气体摩尔体积都约为22.4 L·mol-1
⑥标准状况下,体积相同的气体的分子数相同
A. ①③⑤B. ④⑥C. ②④⑥D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是( )
K2S+N2↑+3CO2↑,下列说法中正确的是( )
A.该反应中的还原剂为KNO3
B.该反应中C被还原
C.若消耗32g S,该反应转移电子数为4 NA
D.若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
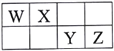
A. 原子半径大小:Z>Y>X
B. 最高价氧化物对应水化物的酸性:W>Y>Z
C. Y单质具有杀菌能力,Y与W可形成化合物WY2
D. W元素和氢元素形成的化合物可与Z单质反应,但不能与Z的氢化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
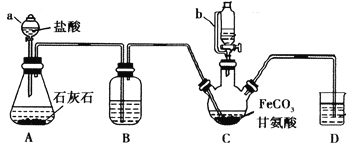
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
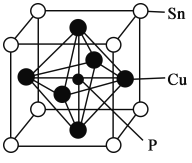
【题目】碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________,据此推测,锡的常见正价是__________。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________;P、S的第一电离能(I1)的大小为I1(P) __________I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________;乙烯分子中σ键与π键数目之比为__________。
(4)NH3的沸点__________(填“高于”或“低于”)PH3的沸点,原因是____________________。
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________nm(用含NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
A. 向稀盐酸中逐滴加入过量的![]() 溶液
溶液
B. 向![]() 溶液中逐滴加入过量稀
溶液中逐滴加入过量稀![]() 溶液
溶液
C. 向![]() 溶液中逐滴加入稀氨水
溶液中逐滴加入稀氨水
D. 向氢氧化钡溶液中通入过量![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com