
【题目】碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________,据此推测,锡的常见正价是__________。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________;P、S的第一电离能(I1)的大小为I1(P) __________I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________;乙烯分子中σ键与π键数目之比为__________。
(4)NH3的沸点__________(填“高于”或“低于”)PH3的沸点,原因是____________________。
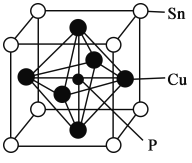
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________nm(用含NA的代数式表示)。
【答案】5s25p2 +2、+4 三角锥形 > sp2 5:1 高于 NH3分子间能形成氢键,而PH3不能 正八面体 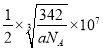
【解析】
(1)锡在第五周期ⅣA族元素,其价电子为最外层电子数,价电子排布式为5s25p2,第四主族常见价态为+2、+4价;
(2)N、P为同主族元素,和NH3的分子构型相同,NH3为三角锥型,则PH3为三角锥型;第一电离能在同周期中随原子序数的递增,有增大的趋势,但核外电子拍布满足充满或半充满状态时,第一电离能大于其后面的元素的第一电离能,故I1(P)>I1(S);
(3)CO32-中C原子孤对电子数=![]() (a-所带电荷-xb)=
(a-所带电荷-xb)=![]() (4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4)氢键为分子间的作用力,对物质的熔沸点影响较大,氢键存在于,氨分子间存在氢键,磷化氢无氢键,则氨的沸点高于磷化氢;
(5)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构;P原子与最近的Cu原子之间的距离为:![]() 棱长,Sn原子:8×
棱长,Sn原子:8×![]() =1,Cu原子:6×
=1,Cu原子:6×![]() =3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=
=3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=![]() cm,P与最近的Cu原子的核间距为
cm,P与最近的Cu原子的核间距为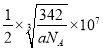 ;
;
(1)锡在第五周期ⅣA族元素,其价电子为最外层电子数,价电子排布式为5s25p2,第四主族常见价态为+2、+4价;
(2)N、P为同主族元素,和NH3的分子构型相同,NH3为三角锥型,则PH3为三角锥型;第一电离能在同周期中随原子序数的递增,有增大的趋势,但核外电子拍布满足充满或半充满状态时,第一电离能大于其后面的元素的第一电离能,故I1(P)>I1(S),答案为:三角锥型;>;
(3)CO32-中C原子孤对电子数=![]() (a-所带电荷-xb)=
(a-所带电荷-xb)=![]() (4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4)氢键为分子间的作用力,对物质的熔沸点影响较大,氢键存在于,氨分子间存在氢键,磷化氢无氢键,则氨的沸点高于磷化氢,答案为:高于;NH3分子间能形成氢键,而PH3不能;
(5)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构;P原子与最近的Cu原子之间的距离为:![]() 棱长,Sn原子:8×
棱长,Sn原子:8×![]() =1,Cu原子:6×
=1,Cu原子:6×![]() =3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=
=3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=![]() cm,P与最近的Cu原子的核间距为
cm,P与最近的Cu原子的核间距为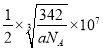 ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲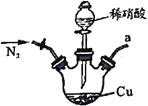 乙
乙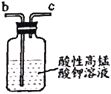 丙
丙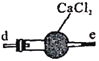 丁
丁![]()
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:CuSO45H2O(s)=CuSO4(s)+5H2O(l) ΔH=+Q1kJ·mol-1;室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2kJ,则()
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,只改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g)的影响如图所示,下列说法正确的是( )
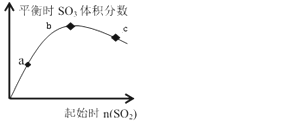
A. 反应a、b、c点均为平衡点,且b点时SO2的转化率最高
B. b点时SO2与O2 的物质的之比约为2:1
C. a、b、c 三点平衡常数: Kb>Kc>Ka
D. a、b、c 三点反应速率大小为: vb>vc>va
查看答案和解析>>
科目:高中化学 来源: 题型:
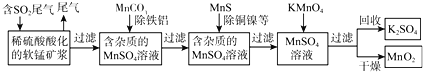
【题目】SO2排放至空气中会造成大气污染,某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
根据以上信息写出用MnO2脱硫的热化学方程式是______
(2)第二步加入MnCO3其原因是______
(3)若最后一步所加KMnO4恰好反应完全,如何证明过滤所得的MnO2固体已洗涤干净:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一个原电池。
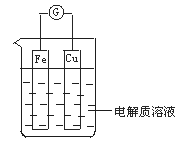
(1)当电解质溶液为稀硫酸时:
①Fe电极是__(填“正”或“负”)极,其电极反应为___。
②Cu电极是__极,其电极反应为___。
(2)由铜、锌和稀硫酸组成的原电池中,铜是__极,电极反应式是__;锌是__极,电极反应式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲用化学方法测量一个不规则容器的体积,把40 g NaOH放入烧杯中,加入一定量的蒸馏水。待NaOH完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器,从中取出溶液100 mL,该溶液恰好与20mL 1mol/L CuSO4溶液完全反应。
(1)写出CuSO4的摩尔质量______________。
(2)求配制的NaOH溶液的物质的量浓度______________。
(3)试计算该容器的体积______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠俗称纯碱,在日常生活和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3(反应的化学方程式为NH3 + CO2 + H2O + NaCl = NaHCO3↓+ NH4Cl),然后再将NaHCO3制成Na2CO3。
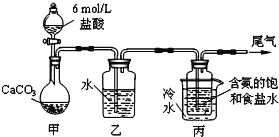
(1)装置乙的作用是_________。为防止污染空气,尾气中含有的_________需要进行吸收处理。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、_______、____。NaHCO3转化为Na2CO3的化学方程式为_____________。
(3)若在(2)中反应时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3样品的组成进行了以下探究:取加热了t1 min的NaHCO3样品27.4g完全溶于水制成溶液,然后向此溶液中不断滴加1mol·L-1的稀盐酸直到不再产生气泡,共消耗400 mL稀盐酸。请回答下列问题:
①根据实验的需要,用密度为1.19g ·cm-3 质量分数为36.5%的浓盐酸配制1mol·L-1的稀盐酸时,主要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和____(填仪器名称);需要量取的浓盐酸体积为:_____mL。
② 该样品中NaHCO3和Na2CO3的物质的量之比是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com