
【题目】在一定温度下,只改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g)的影响如图所示,下列说法正确的是( )
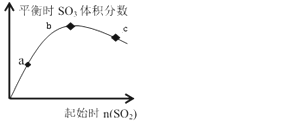
A. 反应a、b、c点均为平衡点,且b点时SO2的转化率最高
B. b点时SO2与O2 的物质的之比约为2:1
C. a、b、c 三点平衡常数: Kb>Kc>Ka
D. a、b、c 三点反应速率大小为: vb>vc>va
【答案】B
【解析】
分析图像我们可知,在一定范围内,随着二氧化硫起始浓度的提高,平衡时三氧化硫的体积分数也会随之提高,但是当二氧化硫的起始浓度超过一定限度后,平衡时三氧化硫的体积会随着其增大而减小。
A.曲线上的点为平衡状态,当氧气的量一定时,二氧化硫的起始量越少,则二氧化硫的转化率越大,a点时SO2的转化率最大,故A错误;
B.由2SO2(g)+O2(g)2SO3(g)可知,b点时SO2与O2的物质的量之比约为2:1,SO3的体积分数最大,故B正确;
C.温度不变,则平衡常数不变,a、b、c三点平衡常数:Kb=Kc=Ka,故C错误;
D.浓度越大,反应速率越快,则a、b、c三点反应速率大小为:vc>vb>va,故D错误;
故选B。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式:_____________________________________;
(2)除去Mg粉中的Al粉的试剂是__________ ,反应的离子方程式为:____________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+__(_______)
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是________________;还原剂是_______________;当有11molP参加反应,转移的电子的物质的量为________;1molCuSO4能氧化的P原子的数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是( )
K2S+N2↑+3CO2↑,下列说法中正确的是( )
A.该反应中的还原剂为KNO3
B.该反应中C被还原
C.若消耗32g S,该反应转移电子数为4 NA
D.若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
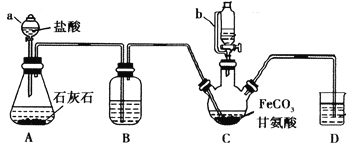
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下:
离子 |
|
|
|
|
|
|
|
|
培养液浓度 | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________,据此推测,锡的常见正价是__________。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________;P、S的第一电离能(I1)的大小为I1(P) __________I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________;乙烯分子中σ键与π键数目之比为__________。
(4)NH3的沸点__________(填“高于”或“低于”)PH3的沸点,原因是____________________。
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________nm(用含NA的代数式表示)。
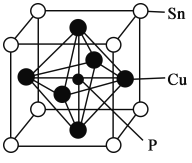
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。
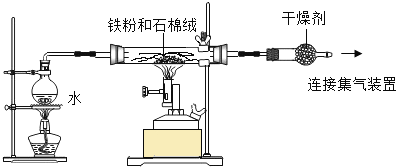
资料:在不同温度下,铁粉与水蒸气反应的产物不同。
Fe +H2O![]() FeO+H2 3Fe + 4H2O
FeO+H2 3Fe + 4H2O![]() Fe3O4 + 4H2
Fe3O4 + 4H2
实验一:某兴趣小组用下图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。
(1)实验过程中,应先点燃___________(选填“酒精灯”或“酒精喷灯”);目的是__________________,装置中石棉绒的作用是_____________________。
(2)若在实验中的某段时间内生成H2 0.2g,则这段时间内参加反应的铁粉质量至少是___________g。
实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图。
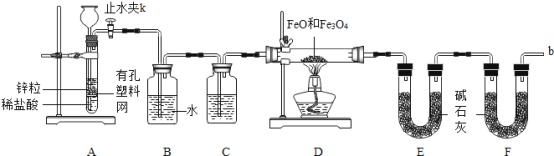
(1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差__________,则气密性良好。
(2)装置A中发生的反应方程式_______________________________________。
(3)为了安全,在点燃酒精灯之前,在F装置出口b处必须______________________。
(4)装置C中所放试剂为_________,装置B的作用是_________________________。
(5)干燥管E右边又连接干燥管F的目的是_________________________________。
若无干燥管F,测得Fe3O4的质量将_______________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)天然气的主要成分是_____(写化学式),其分子空间构型是_____;
(2)苯与液溴在铁粉为催化剂时发生反应的化学方程式_____;反应类型为_____;
(3)写出Na与水反应的离子方程式_____;
(4)CH2=CH﹣CH=CH2与H2在一定条件下发生1,4﹣加成反应的化学方程式_____;
(5)萘的结构简式是![]() ,其分子式_____;一氯代物有_____种。
,其分子式_____;一氯代物有_____种。
(6)某摩尔质量为42gmol﹣1的链烃A可使溴水褪色,A的结构简式为_____;A在一定条件下可以发生加聚反应,产物的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com