
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液面左边低于右边,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
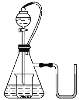
A.过氧化钠B.氧化钠C.钠D.氯化钠
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以2氯苯甲醛为原料合成该药物的路线如下:

(1)A中官能团名称为___________。
(2)C生成D的反应类型为___________。
(3)X( C6H7BrS)的结构简式为____________________________。
(4)写出C聚合成高分子化合物的化学反应方程式:______________________________。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有___________种。
①除苯环之外无其他环状结构;②能发生银镜反应。
其中核磁共振氢谱中有5个吸收峰,且峰值比为2︰2︰1︰1︰1的结构简式为___________。
(6)已知: 。写出以乙烯、甲醇为有机原料制备化合物
。写出以乙烯、甲醇为有机原料制备化合物![]() 的合成路线(无机物任选)_____________。
的合成路线(无机物任选)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题。

(1)该浓盐酸中HCl的物质的量浓度为__________molL﹣1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是_________。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl﹣的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次,并在操作步骤空白处填上适当仪器名称)_________。
A.用30 mL水洗涤__2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用__加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”,填B表示“偏小”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面__;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mLNaOH溶液中逐滴加入0.lmol/L的HR溶液,测得反应混合液中c水(OH-)与V(HR)的变化关系如图所示。下列说法不正确的是

A. V2=10
B. HR为弱酸
C. 当V(HR)=V2时,溶液中存在:c (OH-)-c(H+)=c(HR)
D. 当V(HR)=V1或V3时,溶液中均有:c(Na+)=c(HR)+c(R-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】98gH2SO4中
(1)分子个数是_____
(2)O原子物质的量是___mol
(3)H元素的质量是______g
(4)S原子个数是__
(5)电子的物质的量是_____mol
(6)质子的个数是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,燃煤脱硫是科研工作者研究的重要课题之一,主要脱硫方法有以下几种:
Ⅰ.石灰法原理为:2CaO(s)+2SO2(g)+O2(g)2CaSO4(s)
(1)T1℃时,向10L恒容密闭容器中加入3molCaO(s),并通入2molSO2(g)和1molO2(g)发生上述反应,2min时达平衡,此时CaSO4(s)为1.8mol。0~2min内,用SO2(g)表示的该反应的速率v(SO2)=__________________________。
Ⅱ.催化氧化法
活性炭催化氧化法是基于活性良好的物理吸附和化学吸附作用,其反应机理为:
O2+2C→2C—O;SO2+C→C—SO2;C—SO2+C—O→C—SO3+C;
C—SO3+H2O→C—H2SO4;C—H2SO4→H2SO4+C。
(2)整个过程中总的化学反应方程式为__________________________________________。
(3)活性炭在反应过程中作催化剂,改变了_____________(填选项字母)。
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能
Ⅲ.CO还原法原理为2CO(g)+SO2(g)S(g)+2CO2(g) ΔH
已知:S(g)+O2(g)=SO2(g) ΔH1=-574.0kJ·mol-1;CO燃烧热为283.0kJ·mol-1。
(4)起始温度为T2℃时,分别在三个容积均为10L的绝热密闭容器中,发生反应2CO(g)+SO2(g)S(g)+2CO2(g),测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | A |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
①容器乙达到平衡后,保持其他条件不变,再向其中充入CO(g)、 SO2(g)、S(g)、CO2(g)各1mol,此时v(正)__________ v(逆)。(填“>”、“<”或“=”)。
②下列判断正确的是________________(填选项字母)。
A.b=1.6 B.平衡常数甲>乙 C.达到平衡的时间:丙<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是![]()
![]()
A. 标准状况下,22.4LCO和CO2的混合物中,含碳原子的数目为NA
B. 14g分子式为C5H10的烃中,含有的碳碳双键的数目为0.2NA
C. 0.1mol/L的CH3COONH4溶液中,含铵根离子数目小于0.1NA
D. 标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则25 ![]() 时水的电离平衡曲线应为_______(填“A”或“B”), 请说明理由____________________________________
时水的电离平衡曲线应为_______(填“A”或“B”), 请说明理由____________________________________
(2)25![]() 时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为_________
时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为_________
(3)95![]() 时,若100体积 pH1=a 的某强酸溶液与10体积 pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的 pH1与强碱的 pH2之间应满足的关系是__________________
时,若100体积 pH1=a 的某强酸溶液与10体积 pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的 pH1与强碱的 pH2之间应满足的关系是__________________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量为
A. (b-a)molB. (2b-a)molC. 2(b-a)molD. 2(2b-a)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com