
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是( )
2Z(g),此反应达到平衡的标志是( )
A. 容器内密度不随时间变化B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2D. 单位时间消耗0.1mol X同时生成0.2mol Z
科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.Na ![]() Na2O
Na2O![]() NaOH
NaOH
B.MgCO3![]() MgCl2
MgCl2![]() Mg
Mg
C.Al2O3![]() Al
Al![]() Fe
Fe
D.Fe2O3![]() FeCl3
FeCl3![]() FeCl2(aq)
FeCl2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC–CHO)是重要的精细化工产品。工业上电解乙二醛和盐酸的混合液制备乙醛酸(OHC–COOH)的装置如图所示,通电后,阳极产物将乙二醛氧化为乙醛酸。下列说法错误的是()
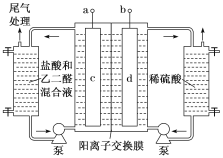
A.a为电源的正极,c电极反应式为2Cl–-2e–=Cl2
B.当1mol乙二醛氧化成1mol乙醛酸时,阴极生成22.4L(标准状况)气体
C.电解过程中稀H2SO4电解液的浓度保持不变
D.阳极液中盐酸的作用有生成氧化剂、增强溶液导电性、提供离子平衡阴极区电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值,下列说法不正确的是
为阿伏伽德罗常数的值,下列说法不正确的是
A.常温下,1LpH=10的![]() 溶液中所含
溶液中所含![]() 的数目为
的数目为![]() NA
NA
B.氯碱工业中转移2mol电子时,通过阳离子交换膜的![]() 的数目为2NA
的数目为2NA
C.过量的铜与含0.2mol![]() 的浓硝酸反应,转移电子的数目大于0.1NA
的浓硝酸反应,转移电子的数目大于0.1NA
D.室温下向1LpH=1的醋酸溶液中加水稀释,所得溶液中![]() 的数目大于0.1NA
的数目大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是______________(填序号)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学反应方程式:________________。
(3)如何用最简单的方法判断(1)中是否成功制备胶体?_________________________。
(4)取少量制得的胶体加入试管中,再加入少量(NH4)2SO4溶液,观察到的现象是__________,这种现象称为胶体的________________。
(5)Fe(OH)3胶体能稳定存在的主要原因是________(填序号)。
A. 胶粒直径小于1nm B. 胶粒带正电荷
C. 胶粒作布朗运动 D . 胶粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________(填序号)。
A.Fe(OH)3胶体粒子的直径在1~100nm之间 B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质粒子能透过滤纸
(7)向Fe(OH)3胶体中插入电极通电后,Fe(OH)3胶体粒子应该移向_______极,说明该胶体粒子带_____电;提纯Fe(OH)3胶体中混有的少量离子可以用的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究Ba(OH)2和H2SO4反应的实质,利用下图装置进行实验。向20 ml 0.01 mol/L Ba(OH)2 溶液中滴入几滴酚酞溶液,然后向其中匀速逐滴加入2 ml 0.2 mol/L H2SO4溶液。

(1)实验过程中溶液中的现象为________、 ________。
(2)该反应的离子方程式是__________________。
(3)画出反应过程中溶液电导率变化示意图__________________。
(4)解释反应过程中溶液电导率出现上述变化的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组尝试在钢制钥匙上镀铜。
实验I:将钥匙直接浸入0.4 mol·L-1 CuCl2溶液中,20s后取出,钥匙表面变红,但镀层疏松,用纸即可擦掉。
实验II:用图装置对钥匙进行电镀铜。钥匙表面迅速变红,同时有细小气泡产生,精铜表面出现少量白色固体。30s后取出钥匙检验,镀层相对实验I略好,但仍能用纸巾擦掉一部分。经调整实验条件后获得了较好的电镀产品。
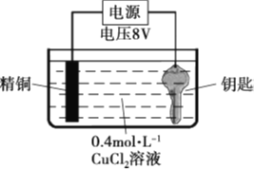
实验III:用0.4 mol·L-1 CuSO4溶液代替CuCl2溶液重复实验II,精铜表面未出现白色固体。
回答下列问题:
(1)实验I反应的化学方程式是_______。
(2)实验II中钥匙应与电源的_______极连接。
(3)钥匙表面产生的气体是_______。
(4)为了避免实验III中钥匙表面产生气体,应该采取的措施是________。
(5)常见化合物中铜元素有+1、+2两种价态,结合实验III推测实验II中精铜表面产生的白色固体的电极反应式是________。(已知CuOH是一种难溶于水的黄色固体)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com