
【题目】将0.34 g Cu和CuO的混合物加入约12 mol·L-1浓硫酸中,并加热使其完全溶解,然后用NaOH溶液中和过量硫酸,再用水稀释到0.5 L,加入纯铁粉1.85 g,反应后过滤、干燥,得不溶物1.89 g。求置换出的铜的质量及原混合物中铜的质量分数___________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当密闭容器中合成氨反应N2+3H2![]() 2NH3达到平衡后,保持温度不变,将容器的容积压缩为原来的1/2。达到新平衡后,与原平衡相比较,下列说法中正确的是
2NH3达到平衡后,保持温度不变,将容器的容积压缩为原来的1/2。达到新平衡后,与原平衡相比较,下列说法中正确的是
A. 容器内的总压强为原来的2倍 B. N2的浓度比原来平衡浓度小
C. H2的转化率为原来的2倍 D. 气体的密度为原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是( )

A.过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程Ⅱ,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示A、B、C、D、E五种仪器:
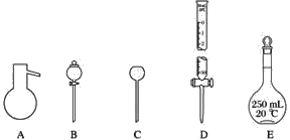
(1)请选择下列仪器名称的序号,填入相应的横线上:
①蒸馏烧瓶 ②碱式滴定管 ③圆底烧瓶 ④长颈漏斗⑤分液漏斗 ⑥酸式滴定管 ⑦容量瓶
A:__________,B:__________,C:__________,D:________,E:________。
(2)上述A~E五种仪器中,使用前必须检漏的有________,组装气体发生器必须液封的是________。
(3)下列仪器中,
![]()
在灼烧固体物质时必须用到的仪器是________________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化碘![]() 是一种重要的卤素互化物,在化工生产中有广泛应用。有关一氯化碘的部分信息如下:
是一种重要的卤素互化物,在化工生产中有广泛应用。有关一氯化碘的部分信息如下:

某小组拟设计实验制备一氯化碘并测定其纯度,装置如图所示。

按如图所示装置进行实验,当D装置中产生红棕色液体、固体消失时停止反应。
请回答下列问题:
(1)盛装碘单质的仪器名称是_____________;E装置作用是_____________。
(2)![]() 装置中试剂名称是______________________________。
装置中试剂名称是______________________________。
(3)写出A中反应的离子方程式______________________。
(4)启动反应后,将D装置的仪器放置于冷水浴中,其目的是__________________。
(5)粗产品中混有碘单质,提纯产品可选择下列装置中的_____________![]() 填字母
填字母![]() 。
。

(6)测定产品纯度。取![]() 该产品于锥形瓶,加入过量的KI溶液,充分反应。用
该产品于锥形瓶,加入过量的KI溶液,充分反应。用![]() 溶液滴定
溶液滴定![]() 有关反应:
有关反应:![]() ,
,![]() ,三次平行实验测得数据如下:
,三次平行实验测得数据如下:
![]()
该产品纯度为___________![]() 用含a和c的代数式表示
用含a和c的代数式表示![]() ;若产品中混有少量
;若产品中混有少量![]() ,测得结果_______________
,测得结果_______________![]() 填“偏高”“偏低”或“无影响”
填“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠![]() 是一种重要的化工产品,将
是一种重要的化工产品,将![]() 通入
通入![]() 和
和![]() 混合溶液中可制得
混合溶液中可制得![]() 。其制备装置如下图所示。
。其制备装置如下图所示。

(1)![]() 中反应的化学方程式为________。
中反应的化学方程式为________。
(2)为保证![]() 和
和![]() 得到充分利用,两者的物质的量之比应为________。
得到充分利用,两者的物质的量之比应为________。
(3)为了保证硫代硫酸钠的产量,实验中通入的![]() 不能过量,原因是________。
不能过量,原因是________。
(4)待![]() 和
和![]() 完全消耗后,结束反应。过滤B中的混合物,滤液经过________、________
完全消耗后,结束反应。过滤B中的混合物,滤液经过________、________![]() 填操作名称
填操作名称![]() 、过滤、洗涤、干燥,得到
、过滤、洗涤、干燥,得到![]() 晶体。
晶体。
(5)称取![]() 产品
产品![]() ,相对分子质量为
,相对分子质量为![]() ,配成250mL溶液,取
,配成250mL溶液,取![]() 溶液,以淀粉作指示剂,用
溶液,以淀粉作指示剂,用![]() 碘的标准溶液滴定。
碘的标准溶液滴定。![]() 反应原理为:
反应原理为:![]() ,忽略
,忽略![]() 与
与![]() 反应
反应![]() 。
。
①滴定终点的现象为________。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则![]() ________,产品的纯度为________。
________,产品的纯度为________。

实验序号 | 消耗标准溶液体积 |
1 |
|
2 |
|
3 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓是继硅之后研究最深人、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________,As基态原子核外有__________个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________,Ga、As、Se的电负性由大到小的顺序是__________________。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________,GaF的熔点超过1000℃,可能的原因是__________________________。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________,草酸根离子中碳原子的杂化轨道类型为__________。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________g·cm-3(设NA为阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com