
【题目】砷化镓是继硅之后研究最深人、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________,As基态原子核外有__________个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________,Ga、As、Se的电负性由大到小的顺序是__________________。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________,GaF的熔点超过1000℃,可能的原因是__________________________。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________,草酸根离子中碳原子的杂化轨道类型为__________。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________g·cm-3(设NA为阿伏加德罗常数的值,列出计算式即可)。

【答案】[Ar]3d104S24p1或1S22S22p63d104S24p1 3 As>Se>Ga Se>As>Ga GaCl3、GaBr3、GaI3的熔沸点依次升高,原因是它们均为分子晶体,相对分子质量依次增大 GaF3是离子晶体 4 sp2 4×145/(0.565×10-7)3NA
【解析】
(1)Ga是31号元素,处于第四周期IIIA族,结合构造原理书写核外电子排布式;As基态原子核外电子排布式为1s22s22p63s23p63d104s24p3;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,As原子4p轨道为半充满稳定状态,第一电离能共用同周期相邻元素的;同周期主族元素自左而右电负性增大;
(3)GaCl3、GaBr3、GaI3均属于分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;F元素的电负性很强,GaF3的熔点超过1000℃,可能的原因是GaF3是离子晶体;
(4)Ga原子与周围4个O原子形成4个共价键;草酸根中碳原子形成3个σ键,没有孤电子对,杂化轨道数目为3;
(5)均摊法计算晶胞中Ga、As原子数目,再计算晶胞质量,晶体密度=晶胞质量÷晶胞体积。
(1)Ga是31号元素,处于第四周期IIIA族,核外电子排布式为1s22s22p63s23p63d104s24p1,As基态原子核外电子排布式为1s22s22p63s23p63d104s24p3,4p轨道3个电子是未成对电子;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,As原子4p轨道为半充满稳定状态,第一电离能大于同周期相邻元素的,故第一电离能:As>Se>Ga,同周期主族元素自左而右电负性增大,故电负性:Se>As>Ga;
(3)GaCl3、GaBr3、GaI3均为分子晶体,相对分子质量依次增大,分子间作用力增强,GaCl3、GaBr3、GaI3的熔沸点依次升高;F元素的电负性很强,GaF3的熔点超过1000℃,可能的原因是GaF3是离子晶体;
(4)Ga原子与周围4个O原子形成4个共价键,镓原子的配位数为4,草酸根中碳原子形成3个σ键,没有孤电子对,杂化轨道数目为3,草酸根中碳原子的杂化轨道类型为sp2;
(5)晶胞中Ga原子数目=8×![]() +6×
+6×![]() =4、As原子数目=4,晶胞质量=4×
=4、As原子数目=4,晶胞质量=4×![]() g,晶体密度
g,晶体密度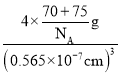 =
=  g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】将0.34 g Cu和CuO的混合物加入约12 mol·L-1浓硫酸中,并加热使其完全溶解,然后用NaOH溶液中和过量硫酸,再用水稀释到0.5 L,加入纯铁粉1.85 g,反应后过滤、干燥,得不溶物1.89 g。求置换出的铜的质量及原混合物中铜的质量分数___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度关系的叙述正确的是( )
A. 0.1 mol·L1 NH4NO3溶液中:c(![]() )>c(
)>c(![]() )>c(H+)>c(OH)
)>c(H+)>c(OH)
B. 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO)=c(CO32)+c(HCO3)+c(H2CO3)
C. 向10 mL 0.2 mol·L1 NaCl溶液中滴入2 mL 0.1 mol·L1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(![]() )=c(Cl)>c(Ag+)
)=c(Cl)>c(Ag+)
D. 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L1·s1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH 与微粒浓度的变化关系如图所示。 下列说法错误的是( )

A.若向0.1mol/L BOH溶液中加水稀释,则溶液中c(OH-)/c(BOH) 增大
B.室温下,BOH的电离平衡常数K = 1×10-4.8
C.P点所示的溶液中:c(Cl-) > c(B+)
D.N点所示的溶液中: c(H+) = c(Cl-) + c(OH-) - c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,11℃时液化成红棕色液体。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
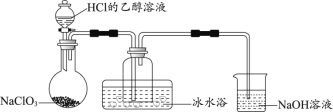
①冰水浴的作用是____________。
②NaOH溶液的主要作用为吸收反应产生的Cl2,其吸收液可用于制取漂白液,该吸收反应的氧化剂与还原剂之比为___________________。
③以NaClO3和HCl为原料制备ClO2的化学方程式为_________________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到________,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生Cl-,其含量一般控制在0.3-0.5 mg·L1,某研究小组用下列实验方案测定长期不放水的自来水管中Cl-的含量:量取10.00 mL的自来水于锥形瓶中,以K2CrO4为指示剂,用0.0001mol·L-1的AgNO3标准溶液滴定至终点。重复上述操作三次,测得数据如下表所示:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液的体积/mL | 10.24 | 10.02 | 9.98 | 10.00 |
①在滴定管中装入AgNO3标准溶液的前一步,应进行的操作_____________。
②测得自来水中Cl-的含量为______ mg·L1。
③若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于电离方程式的是( )。
A.2H2O ![]() H3O++OH-B.CH3COOH+H2O
H3O++OH-B.CH3COOH+H2O ![]() CH3COO-+H3O+
CH3COO-+H3O+
C.H2CO3![]() H++HCO3-D.CH3COOH+NaOH = CH3COONa+H2O
H++HCO3-D.CH3COOH+NaOH = CH3COONa+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法不正确的是( )
A. 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>①
B. 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性
C. 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④
D. 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。下列说法错误的是( )
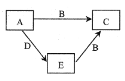
A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B. Y的最高价氧化物的水化物为弱酸
C. Y、Z组成的分子可能为非极性分子
D. W是所在周期中原子半径最小的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com