
����Ŀ��ʵ������⣺ʵ������Ҫ��ȡһƿ���������������������ͼ������ҩƷ�ɹ�ʹ�ã� 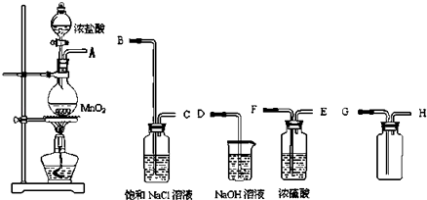
��1��ʵ������ȡ������ԭ����������HCl�����ֵ������� ��
��2������������������ȷ˳���ǣ�����ӿڴ�����ĸ���� �� �� �� �� �� �� ��
��3��������װ���У��ֱ�ʢװ��һЩ��Һ����˵����װ��Һ�����ã�����ʳ��ˮ����������Ũ��������������������Ƶ������� ��
��4��ʢװNaOH��Һ���Լ�ƿ�з����Ļ�ѧ��ӦΪ�� ��
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�����ԡ���ԭ��
MnCl2+Cl2��+2H2O�����ԡ���ԭ��
��2��A��B��C��F��E��G��H��D
��3����ȥ�Ȼ����������壻�������������ն��������
��4��2NaOH+Cl2 =NaCl+NaClO+H2O
���������⣺��1��ʵ�������ö������̺�Ũ���ᷴӦ������������Ӧ�Ļ�ѧ����ʽ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����Ӧ�У�MnԪ�صĻ��ϼ۽��ͣ�ClԪ�صû��ϼ����ߣ���MnO2Ϊ��������HClΪ��ԭ�����ɷ���ʽ��֪�����Ȼ������ȵĻ��ϼ�δ�䣬���ԣ������ڷ�Ӧ�������Ժͻ�ԭ�������ã� ���Դ��ǣ�MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O����Ӧ�У�MnԪ�صĻ��ϼ۽��ͣ�ClԪ�صû��ϼ����ߣ���MnO2Ϊ��������HClΪ��ԭ�����ɷ���ʽ��֪�����Ȼ������ȵĻ��ϼ�δ�䣬���ԣ������ڷ�Ӧ�������Ժͻ�ԭ�������ã� ���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�����ԡ���ԭ�ԣ���2��ʵ�����õ�һ��װ���Ʊ�����������ֱ�ͨ��ʢ�б����Ȼ�����Һ��ϴ��ƿ��ʢ��Ũ�����ϴ��ƿ�����Ӹ�����������ſշ��ռ������������ж�������ֱ���ŷŵ������У�Ӧ��ʢ��NaOH��Һ��װ�����գ�
MnCl2+Cl2��+2H2O�����ԡ���ԭ�ԣ���2��ʵ�����õ�һ��װ���Ʊ�����������ֱ�ͨ��ʢ�б����Ȼ�����Һ��ϴ��ƿ��ʢ��Ũ�����ϴ��ƿ�����Ӹ�����������ſշ��ռ������������ж�������ֱ���ŷŵ������У�Ӧ��ʢ��NaOH��Һ��װ�����գ�
���Դ��ǣ�ABCFEGHD����3�������ӷ���������ȡ�������л����Ȼ��������ˮ�������Ȼ��⼫������ˮ������Ҳ������ˮ�����Բ�����ˮ��ȥ�Ȼ������壻������ˮ��Ӧ��������ʹ����ᣬ����ʳ��ˮ�к��������ӣ��������������ܽ⣬���Ա���ʳ��ˮ�������dz�ȥ�Ȼ����������壻Ũ���᳣�������ܸ������ԡ��������壬��ѡŨ����������������������������������Һ���գ�
���Դ��ǣ���ȥ�Ȼ����������壻�������������ն������������4�������ж�����Ⱦ���������Բ���ֱ���ſգ������ܺ��������Ʒ�Ӧ2NaOH+Cl2 =NaCl+NaClO+H2O�����Կ�������������Һ���ն����������
���Դ��ǣ�Cl2+2NaOH=NaCl+NaClO+H2O��
�����㾫��������������ʵ�����Ʒ��ǽ����ĸ�������Ҫ֪��ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O��


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǵ��ճ�����ϢϢ��أ������������ʵ�˵����ȷ���ǣ� ��
A.���������ζ
B.���ۺ���ά�ؾ���������
C.���������ˮ��
D.�������C��H��OԪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Z��ԭ���������������ͬһ������Ԫ�أ�W��X�ǽ���Ԫ�أ�Z�Ƿǽ���Ԫ�أ�W��X������������Ӧ��ˮ����������Ӧ�����κ�ˮ����һ������W������������Ӧ��ˮ������Һ����μ���XZ3��Һ�����ɵij���X��OH��3��������XZ3��Һ�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ� �� 
A.d���Ӧ����Һ�У�K+��NH4+��C032����I��
B.c���Ӧ����Һ�У�Ag+��Ca2+��NO3����Na+
C.b���Ӧ����Һ�У�Na+��S2����SO42����Cl��
D.a���Ӧ����Һ�У�Na+��K+��S042����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25mL 2molL��1 Na2CO3��75mL 1molL��1��ϡ����ٽ�Na2CO3��Һ�����ε�ϡ�����С��ڽ�ϡ���Ỻ���ε�Na2CO3��Һ�У��ڱ�״���²���������������ǣ� ��
A.��Ϊ0.84 L
B.��Ϊ0.56 L
C.�٣���
D.�ڣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��Ũ������ֳ�������(������)��Ӧ��ϵ��ȷ����(����)
A. �ڿ����г��ھ��õ�Ũ���ᣬ��Һ��������(�ѻӷ���)
B. �ڼ���������ͭ��Ũ���ᷴӦ(ǿ�����ԡ�����)
C. ������Ũ���ᷴӦ���к���״��̿����(��ˮ��)
D. Ũ�������������ijЩ����(��ˮ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL FeI2��Һ����ͨ��Cl2 �� ����������Cl����I2��Fe3+��IO3�� �� ����Fe3+��I2�����ʵ�����n��Cl2���ı仯��ͼ��ʾ����ش��������⣺ 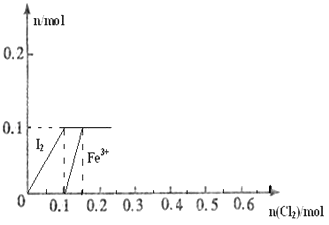
��1����ͼ��֪��I����Fe2+��I2�������ӵĻ�ԭ����ǿ������˳��Ϊ���� ��
��2����n��Cl2��=0.12molʱ����Һ�е�������ҪΪ �� �ӿ�ʼͨ��Cl2��n��Cl2��=0.12molʱ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
��3������Һ��n��Cl������n��IO3����=8��1ʱ��ͨ���Cl2�ڱ�״���µ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵����ȷ����
A.1mol��ϩ�Ậ��NA�������ͼ�
B.��״���£�11.2L�ı��к���3NA��̼���
C.0.1mol/L��Na3PO4��Һ�к��е���������������0.1NA
D.1L1.0mol/L��Na2SiO3��Һ�к��е���ԭ����Ŀ����3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E��F��Gԭ���������ε���������Ԫ�أ����Ƕ��Ƕ����ڵ�����Ԫ�أ����У�AԪ��ԭ�ӵİ뾶��С��BԪ�ص���̬�⻯��������ۺ����������һ���Σ�Cԭ��M���������K���һ�룻Fԭ�ӵõ��������Ӻ���Arԭ�Ӻ�������Ų���ͬ��C��E��F������������ˮ���ﶼ������֮�䷢����Ӧ����ش��������⣺
��1��Fԭ�ӵ�ԭ�ӽṹʾ��ͼ�� �� GԪ���γɵĵ��ʵĽṹʽΪ ��
��2���õ���ʽ��ʾA��C�γɵĻ�������γɹ��� ��
��3��B��D��E����ԭ�ӵ�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ����Ԫ�ط��Żش� ��
��4�����ۻ�����FG2������ԭ�Ӷ����������8���ӹ��ͣ���д��FG2�ĵ���ʽ ��
��5��д��C��E������������ˮ����֮�䷴Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com