
【题目】甲胺(CH3NH2)的性质与氨气相似。已知pKb=-lgKb,pKb(CH3NH2·H2O)=3.4,pKb(NH3·H2O)=4.8。常温下,向10.00 mL 0. 1000 mol·L-1的甲胺溶液中滴加0. 0500 mol·L-1的稀硫酸,溶液中c(OH-)的负对数pOH=-lgc(OH-)]与所加稀硫酸溶液的体积(V)的关系如图所示。下列说法错误的是
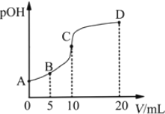
A.B点对应的溶液的pOH>3.4
B.甲胺溶于水后存在平衡:CH3NH2+H2O![]() CH3NH
CH3NH![]() +OH-
+OH-
C.A、B、C三点对应的溶液中,水电离出来的c(H+):C>B>A
D.A、B、C、D四点对应的溶液中,c(CH3NH3+)的大小顺序:D>C>B>A
【答案】D
【解析】
A.B点加入5 mL0.0500 mol/L的稀硫酸,不考虑水解和电离,反应后c(CH3NH3+)=c(CH3NH2),由于pKb(CH3NH2·H2O)=3.4,CH3NH2H2O的电离程度大于CH3NH3+的水解程度,则溶液中c(CH3NH3+)>c(CH3NH2);
B.甲胺(CH3NH2)的性质与氨气相似,说明CH3NH2H2O是一元弱碱,可以部分电离出氢氧根离子;
C.恰好反应时水的电离程度最大,碱过量抑制了水的电离,碱的浓度越大抑制程度越大;
D.C、D点相比,n(CH3NH3+)相差较小,但D点溶液体积较大,则c(CH3NH3+)较小,据此分析。
A.B点加入5 mL0.0500 mol/L的稀硫酸,不考虑水解和电离,反应后c(CH3NH3+)=c(CH3NH2),由于pKb(CH3NH2·H2O)=3.4,pKh(CH3NH3+)=14-3.4=10.6,说明CH3NH2H2O的电离程度大于CH3NH3+的水解程度,则溶液中c(CH3NH3+)>c(CH3NH2),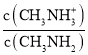 >1,结合Kb(CH3NH2H2O)=
>1,结合Kb(CH3NH2H2O)=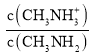 ×c(OH-)=10-3.4可知,c(OH-)<10-3.4,所以B点的pOH>3.4,A正确;
×c(OH-)=10-3.4可知,c(OH-)<10-3.4,所以B点的pOH>3.4,A正确;
B.CH3NH2H2O是一元弱碱,可以部分电离出氢氧根离子,电离过程可逆,则电离方程式为:CH3NH2H2O![]() CH3NH3++OH-,B正确;
CH3NH3++OH-,B正确;
C.用0.0500 mol/L的稀硫酸滴定10 mL 0.1000 mol/L的甲胺溶液滴入10 mL恰好完全反应此时生成的是强酸弱碱盐,溶液显碱性,CH3NH3+水解促进水的电离,A、B点溶液中弱碱过量抑制了水的电离,所以A、B、C三点溶液中,水电离出来的c(H+):C>B>A,C正确;
D.C点硫酸与CH3NH2H2O恰好反应,由于CH3NH3+的水解程度较小,则C、D点n(CH3NH3+)相差较小,但D点加入硫酸溶液体积为C点2倍,则c(CH3NH3+):C>D,D错误;
故合理选项是D。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
【题目】25℃时,AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.Ag2CO3的Ksp为8.1×10-12
B.Ag2CO3(s)+2Cl-(aq)![]() 2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
C.向Ag2CO3的饱和溶液中加入K2CO3(s),可使c(CO32-)增大(由Y点到X点)
D.向同浓度的KCl和K2CO3的混合溶液中滴入0.001mol·L-1AgNO3溶液,CO32-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早掌握炼锌的国家,《天工开物》中记载了以菱锌矿(主要成分为ZnCO3)和烟煤为原料的炼锌罐剖面图。已知:锌的沸点为907 ℃,金属锌蒸气遇热空气或CO2易生成ZnO。下列冶炼锌过程中的相关说法不正确的是
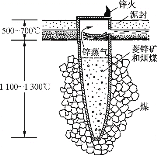
A.尾气可用燃烧法除去
B.发生了氧化还原反应
C.提纯锌利用了结晶法
D.泥封的目的是防止锌氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是
A.较浓盐酸可有效抑制Fe3+水解
B.稀释过程中FeCl3水解程度增大,c(H+)增大
C.FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+
D.FeCl3溶液显黄色,没有Fe(OH)3存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:

已知:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
A.气体X中含有SO2
B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O![]() CuO + 2HCl↑+ 4NH3↑
CuO + 2HCl↑+ 4NH3↑
D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
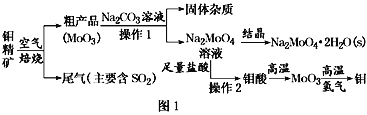
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
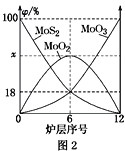
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,几种难溶电解质的溶度积常数Ksp如下表所示(当某种离子浓度≤10-5mol·L-1时,认为完全沉淀):
![]()

下列说法正确的是( )
A.相同温度下,溶度积常数越大相应物质的溶解度就越大
B.欲用1LNaCl溶液将0.01molAgBr转化为AgCl沉淀,则c(NaCl)≥3.61mol/L
C.在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由图中Y点变为X点
D.AgCl悬浊液中存在平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH 和水形成的混合液,通入 SO2 时发生反应生成保险粉和一种常见气体,下列说法错误的是( )
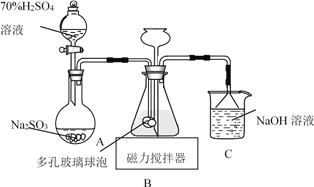
A.制备保险粉的离子方程式为:HCOO-+OH-+2SO2=S2O42-+CO2↑+H2O
B.多孔玻璃球泡的作用是增大气体与溶液的接触面积,使 SO2 能被充分吸收
C.NaOH 溶液的主要作用是吸收逸出的CO2
D.为避免 Na2S2O4 被 O2 氧化,使硫酸与亚硫酸钠先反应,产生的 SO2 排出装置中的 O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com