
【题目】实验室用如图装置进行硫酸亚铁铵[(NH4)2Fe(SO4)2]的分解反应并确定分解产物成分。已知在500℃时隔绝空气加热分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2。下列说法正确的是( )
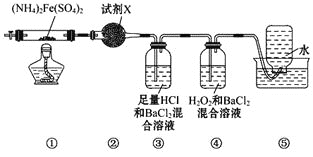
A.取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则气体产物一定有SO2
B.装置②用于检验分解产物中是否有水蒸气生成,试剂X可以使用无水氯化钙
C.装置③的作用就是检验分解产物中是否有SO3气体生成并除去SO3
D.装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
【答案】A
【解析】
实验室用如图装置进行硫酸亚铁铵[(NH4)2Fe(SO4)2]的分解反应, 分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2,②中的试剂应为硫酸铜,用于检验生成的水,③可用于检验SO3并吸收NH3,④用于检验SO2,H2O2可氧化SO2生成H2SO4,⑤用于收集N2,据此分析解答。
A. 如不含Fe2O3,而含有Fe3O4,则加入盐酸可生成氯化铁,滴加KSCN,溶液变红,反应中Fe的化合价升高,若生成N2,N的化合价也升高,则S的化合价降低,则有SO2生成,A项正确;
B. 应用硫酸铜检验水,用无水氯化钙没有明显的现象, B项错误;
C. 装置③中盐酸可吸收氨气,水与三氧化硫反应生成硫酸,可生成硫酸钡沉淀, C项错误;
D. ④用于检验SO2,过氧化氢可氧化SO2生成硫酸,⑤用于收集氮气, D项错误。
答案选A。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是

A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的成分是 Cu2O,辉铜矿的成分是 Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S + 2Cu2O![]() 6Cu + SO2↑,对于该反应的下列说法正确的是( )
6Cu + SO2↑,对于该反应的下列说法正确的是( )
A.该反应中的氧化剂只有 Cu2O
B.Cu2S 在反应中既是氧化剂又是还原剂
C.Cu 既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为 6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A.放电时,负极反应为3NaBr—2e—=NaBr3+2Na+
B.充电时,阳极反应为2Na2S2—2e—=Na2S4+2Na+
C.充电时,Na+经过离子交换膜,由b池移向a池
D.用该电池电解饱和食盐水,产生2.24LH2(标况下)时,b池生成17.40gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
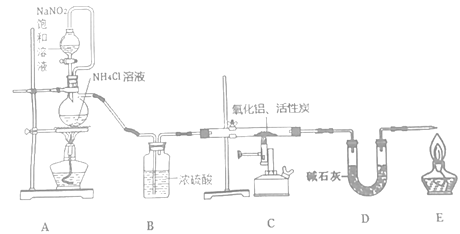
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )

A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等; ②单位时间内amol A生成,同时生成3amol B;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的物质的量不再变化; ⑥单位时间消耗amol A,同时生成3amol B;⑦A 、B、C的分子数目比为1:3:2。
A.②⑤B.①③C.②⑦D.⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com