
【题目】赤铜矿的成分是 Cu2O,辉铜矿的成分是 Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S + 2Cu2O![]() 6Cu + SO2↑,对于该反应的下列说法正确的是( )
6Cu + SO2↑,对于该反应的下列说法正确的是( )
A.该反应中的氧化剂只有 Cu2O
B.Cu2S 在反应中既是氧化剂又是还原剂
C.Cu 既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为 6∶1
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】温度T℃时,在3个体积相同的恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
CO | H2O(g) | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中不正确的是
A.容器②中热量变化:Q1=65.6kJ
B.平衡后容器①②中各组分体积分数相同
C.三个容器达平衡时,①中的CO、②中的H2O(g)、③中的CO2的转化率相等
D.保持相同条件,向平衡后的容器①中再加入0.1molCO和0.4molCO2(g),平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是
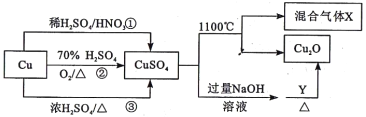
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③
C. 硫酸铜在1100℃分解的方程式为:2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑
Cu2O+SO2↑+SO3↑+O2↑
D. 当Y为葡萄糖时,葡萄糖发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的c(H+)之比为1:1
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
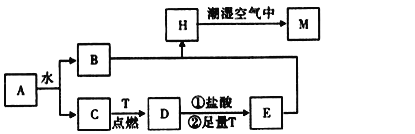
(1)物质A的化学式为___。
(2)H在潮湿空气中变成M的实验现象是__,化学方程式为___。
(3)A和水反应生成B和C的离子方程式为__,列出A的一种重要用途__。
(4)反应①的离子方程式为__,②加足量T的目的___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向25mL0.1mol/LNaOH溶液中逐滴滴加0.2mol/L的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10—4.7)。下列说法正确的是
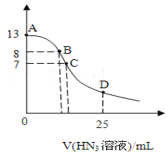
A.水电离出的c(H+):A点大于B点
B.从A点到C点,都存在c(Na+)>c(N3—)>c(OH—)>c(H+)
C.在C点,滴加的V(HN3)>12.5mL
D.在D点,c(Na+)=2c(HN3)+2c(N3—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置进行硫酸亚铁铵[(NH4)2Fe(SO4)2]的分解反应并确定分解产物成分。已知在500℃时隔绝空气加热分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2。下列说法正确的是( )
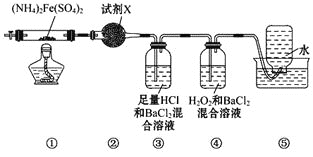
A.取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则气体产物一定有SO2
B.装置②用于检验分解产物中是否有水蒸气生成,试剂X可以使用无水氯化钙
C.装置③的作用就是检验分解产物中是否有SO3气体生成并除去SO3
D.装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1 mol/L的是( )
A.将40 g NaOH固体溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol/L的浓盐酸与9 L水混合
D.10 g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com