
【题目】利用反应2Cu+O2+2H2SO4![]() 2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是________(写名称),电极反应式为_____________________________________。
(2)正极电极反应式为___________________________________________________________。
(3)溶液中![]() 向________极移动。
向________极移动。
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
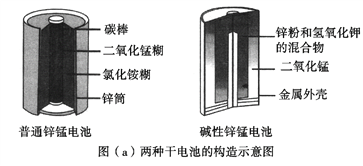
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2==Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是__________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点有_____________________。(任写一条)
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
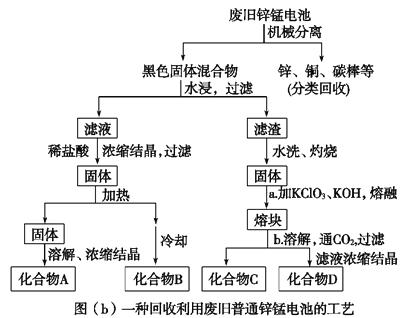
图(b)中产物的化学式分别为A_________________,B______________________。
(3)①操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液D和一种黑褐色固体C,该反应的离子方程式为_________________________。
②采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2 molSO2和1molO2充入 10 L恒容密闭容器中,发生反应:2SO2(g) +O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A. 0~5min内,用O2表示的平均反应速率v(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 molSO2和2 molO2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G7种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素。
(1)A的名称是____________,B位于周期表中第_________周期________族,C的原子结构示意图是________________。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成的化合物的电子式是__________________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是________(填化学式,下同),酸性最强的是_______________,气态氢化物最稳定的是______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B﹣少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的(填序号)①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R>A单质; ④A单质>R>B单质.
(2)在CB3分子中C元素原子的原子轨道发生的是杂化,其固体时的晶体类型为 .
(3)写出D原子的核外电子排布式 , C的氢化物比D的氢化物在水中溶解度大得多的可能原因 .
(4)如图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为 , FeD2物质中具有的化学键类型为 . 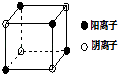
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各图描述不正确的是( ) 
A.在NaCI晶体中,距Na+最近的Cl﹣有6个
B.在BaO2晶胞中,每个晶胞平均占有4个Ba2+和4个O ![]()
C.在金刚石晶体中,碳原子与碳碳键的个数比为1:2
D.该气态分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com