
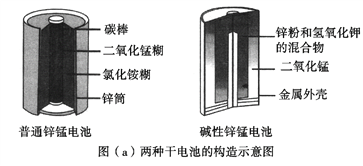
【题目】锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2==Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是__________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点有_____________________。(任写一条)
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
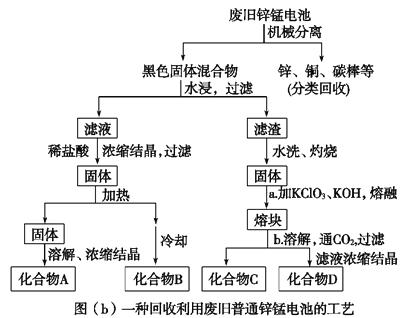
图(b)中产物的化学式分别为A_________________,B______________________。
(3)①操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液D和一种黑褐色固体C,该反应的离子方程式为_________________________。
②采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
【答案】 Zn NH4Cl MnO2+NH![]() +e-===MnOOH+NH3 碱性电池比能量高;可储存时间长;或碱性电池使用寿命长(因为金属材料在碱性电解质比在酸性电解质的稳定性好);碱性电池不容易发生电解质溶液泄漏(因为消耗的负极改装在电池的内部) ZnCl2 NH4Cl 3MnO
+e-===MnOOH+NH3 碱性电池比能量高;可储存时间长;或碱性电池使用寿命长(因为金属材料在碱性电解质比在酸性电解质的稳定性好);碱性电池不容易发生电解质溶液泄漏(因为消耗的负极改装在电池的内部) ZnCl2 NH4Cl 3MnO![]() +2CO2===2MnO
+2CO2===2MnO![]() +MnO2↓+2CO
+MnO2↓+2CO![]() H2
H2
【解析】(1)①根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,反应中Zn被氧化,为电池负极锌,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e-=MnOOH+NH3,故答案为:锌;NH4Cl;MnO2+NH4++e-=MnOOH+NH3;
②与普通锌锰电池相比,碱性锌锰电池的优点有:碱性电池比能量高;可储存时间长;或碱性电池使用寿命长;碱性电池不容易发生电解质溶液泄漏等,故答案为:碱性电池不易发生电解质的泄露、碱性电池的使用寿命较长、碱性电池比能量高等;
(2)废电池经机械分离后,加水溶解后溶液中的成分是氯化铵,再加稀盐酸Zn溶解生成氯化锌,因此浓缩结晶得到氯化铵和氯化锌,氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌,故答案为:ZnCl2 ;NH4Cl;
(3)①绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-,故答案为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-
②采用惰性电极电解K2MnO4溶液生成高锰酸钾发生氧化反应,则阴极发生还原反应,溶液中的氢离子得电子生成氢气,故答案为:H2。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)某温度时,水的离子积Kw=1×10﹣13 , 则该温度25℃(填“>”、“<”或“=”).在此温度下,某溶液中由水电离出来的H+浓度为1×10﹣10 molL﹣1 , 则该溶液的pH可能为;
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液中各种离子的浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是( )
A.10g H2和10g O2
B.5.6L N2(标准状况)和22g CO2
C.9g H2O和0.5mol Br2
D.224mL H2(标准状况)和0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的( )
A.SiH4的沸点高于CH4 , 可推测pH3的沸点高于NH3
B.NH ![]() 为正四面体,可推测出PH
为正四面体,可推测出PH ![]() 也为正四面体结构
也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应2Cu+O2+2H2SO4![]() 2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是________(写名称),电极反应式为_____________________________________。
(2)正极电极反应式为___________________________________________________________。
(3)溶液中![]() 向________极移动。
向________极移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com