
【题目】下列实验操作和结论错误的是( )
A.用新制Cu(OH)2悬浊液可鉴别麦芽糖和蔗糖
B.用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化
C.浓H2SO4可使蔗糖变黑,证明浓H2SO4具有脱水性
D.蔗糖溶液中滴加几滴稀H2SO4,水浴加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙酸与乙酸乙酯互为同分异构体 B. 乙烷室温下能与溴水发生取代反应
C. 医用消毒酒精中乙醇的浓度为9.5% D. 乙烯可以用作生产食品包装材料的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁达尔效应是区分胶体与溶液的一种最常用的方法。
(1)下图是在实验室中进行Fe(OH)3胶体丁达尔效应实验的示意图,该图中有一处明显错误是______________________,原因是_______________________________ (试从分散系分类的角度进行解释说明)。

(2)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是________,理由是_______________________________。
(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,请设计一个你认为最简单、最环保的方法:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:

(1)组成青蒿素的三种元素电负性由大到小排序是 ,在基态O原子中,核外存在 对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是 (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH + B(OCH3)3 → NaBH4+ 3CH3ONa
① NaH为 晶体,右图是NaH晶胞结构,则NaH晶体的配位数是 ,若晶胞棱长为a则Na原子间最小核间距为 。
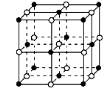
② B(OCH3)3 中B采用的杂化类型是 。写出两个与B(OCH3)3 具有相同空间构型的分子或离子 。
③ NaBH4结构如图所示。结构中存在的作用力有 。
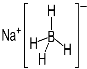
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD, BAD的结构简式为:

BAD的合成路线如下(己知G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程是引入羧基的反应):
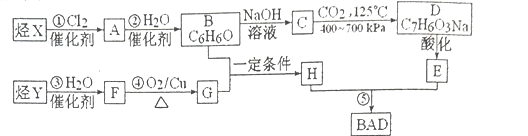
试回答下列问题:
(1)写出Y的结构简式________________;E的含氧官能团名称_______________。
(2)属于加成反应的有__________________(填数字序号)。
(3)1 mol BAD最多可与含________________mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④:______________________________;
F+E→:______________________________;
(5)E有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式 _________________。
A.能发生银镜反应 B.遇FeCl3溶液显紫色 C.核磁共振氢谱图中有4个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铁和稀硫酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.氯化铝溶液中加入过量氨水制取氢氧化铝:Al3++3NH3·H2O![]() Al(OH)3↓+3
Al(OH)3↓+3![]()
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu![]() Fe2++Cu2+
Fe2++Cu2+
D.氢氧化钠溶液中通入少量二氧化硫气体 :SO2+OH![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。

(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com