
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为( )

A. 1∶1∶4
B. 1∶3∶1
C. 3∶3∶8
D. 1∶1∶1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是
A.青菜中含有维生素C
B.维生素C具有还原性
C.致人中毒过程中砷发生还原反应
D.砒霜是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学药品与警示语对应正确的是( )
①酒精——剧毒品 ②浓硫酸——腐蚀品 ③汽油——易燃品 ④烧碱——剧毒品 ⑤氯酸钾——氧化剂 ⑥硝酸铵——爆炸品
A. ①②③⑥ B. ①②⑤ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3。已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:
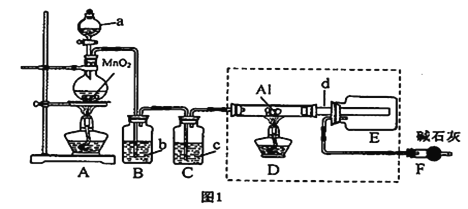
(1)A装置中反应的化学方程式为____________________________。
(2)试剂b为______________。
(3)所用d导管较粗的原因是______________;E装置的作用为______________。
(4)F装置的作用为______________。
(5)若图l中的D、E装置改为下面装置,D装置中的现象为_____________________;用离子方程式表示E中的现象变化____________________________。
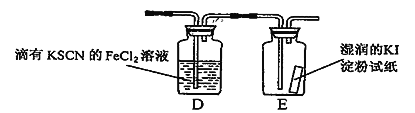
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
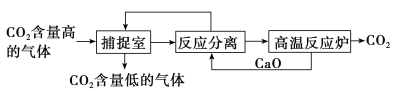
下列有关该方法的叙述中正确的是
①能耗大是该方法的一大缺点
②“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
③该方法可减少碳排放,捕捉到的CO2还可用来制备干冰等产品
④整个过程中,只有一种物质可以循环利用
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2L的密闭器中充入2molA气体和1molB气体,在一定条件下发生如下反应:2A(g)+B(g)3C(g);经2s后达到平衡,测得C气体的浓度为0.6molL﹣1 . 下列说法中正确的是( )
①用物质A表示该反应的平均反应速率为0.2molL﹣1s﹣1
②用物质B表示该反应的平均反应速率为0.2molL﹣1s﹣1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2molL﹣1
⑤其它条件不变,向容器中再加入1molC气体,达到新平衡时,C的体积分数不变.
A.①②③
B.①③⑤
C.②④⑤
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氮的固定的是
①N2和H2在一定条件下反应生成NH3
②雷雨闪电时空气中的N2和O2化合生成NO
③NH3经过催化氧化生成NO
④NH3和HNO3反应生成NH4NO3
A.①③B.②④C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的是溶液变绿的原因,写出产生该物质的电极反应式:。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl ![]() [CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因:。
[CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因:。
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是 , 否定乙的依据是。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]_ , [CuCl2]_掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]_的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是。
② 写出b中生成[CuCl2]_的离子方程式:。
③ 补充c中必要的操作及现象:。
丙据此得出结论:电解时阴极附近生成[CuCl2]_是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe2+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀生成,淡黄色固体的物质的量与产生沉淀的质量关系如图2. 
(1)则溶液中含有的阳离子有 .
(2)写出图2曲线a~b段反应的离子方程式 , .
(3)A溶液中存在的阳离子的物质的量浓度之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com