
����Ŀ��25��ʱ����0.10molL-1�İ�ˮ�ζ�10.00mL0.05molL-1�Ķ�Ԫ��H2A����Һ���ζ������м��백ˮ�����(V)����Һ��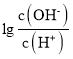 �Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(����)
�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(����)

A.H2A�ĵ��뷽��ʽΪH2AH++HA-
B.B����Һ�У�ˮ�������������Ũ��Ϊ1.0��10-6molL-1
C.C����Һ�У�c(NH4+)+c(NH3H2O)=2c(A2-)
D.25��ʱ����ˮ�ĵ���ƽ�ⳣ��Ϊ![]()
���𰸡�BD
��������
A��0.05molL-1�Ķ�Ԫ��H2A����Һ��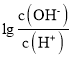 =-12��c(H+)c(OH-)=10-14����c(H+)=0.1mol/L=2c(H2A)��˵���ö�Ԫ����ȫ���룬����H2AΪǿ�ᣬ���뷽��ʽΪH2A=2H++A2-����A����
=-12��c(H+)c(OH-)=10-14����c(H+)=0.1mol/L=2c(H2A)��˵���ö�Ԫ����ȫ���룬����H2AΪǿ�ᣬ���뷽��ʽΪH2A=2H++A2-����A����
B��B����Һ���백ˮ10mL����Ӧǡ������(NH4)2A��笠�����ˮ�⣬��Һ�����ԣ���Һ��H+����ˮ�ĵ��룬��ʱ��Һ��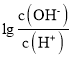 =-2����c(OH-)=10-2c(H+)��c(H+)c(OH-)=10-14������c(H+)=10-6mol/L����ˮ�������������Ũ��Ϊ1.0��10-6mol/L����B��ȷ��
=-2����c(OH-)=10-2c(H+)��c(H+)c(OH-)=10-14������c(H+)=10-6mol/L����ˮ�������������Ũ��Ϊ1.0��10-6mol/L����B��ȷ��
C��C����Һ�к���(NH4)2A��NH3H2O����Һ�����ԣ�c(H+)=c(OH-)�����ݵ���غ��c(NH4+)+c(H+)=c(OH-)+2c(A2-)������c(NH4+)=2c(A2-)����c(NH4+)+c(NH3H2O)��2c(A2-)����C����
D��C����Һ�����ԣ���c(H+)=c(OH-)=10-7 mol/L�����ݵ���غ��c(NH4+)=2c(A2-)=2��![]() mol/L=
mol/L=![]() mol/L�����������غ��c(NH3H2O)=
mol/L�����������غ��c(NH3H2O)=![]() mol/L-
mol/L-![]() mol/L=
mol/L=![]() mol/L����ˮ�ĵ��볣������ʽΪKb=
mol/L����ˮ�ĵ��볣������ʽΪKb=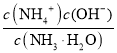 =
=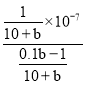 =
=![]() ����D��ȷ��
����D��ȷ��
��ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˾���촼(d)�����������꼰����Dravet�ۺ�������������ߣ���ϳ�·����ͼ��ʾ�������й��ж���ȷ���ǣ� ��

A.b��һ�ȴ�����4��
B.c�ķ���ʽΪC14H14O3
C.1mold�������4molH2�����ӳɷ�Ӧ
D.d������̼ԭ�ӿ��ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ĸ↑����ʮ�������ҹ��ںܶ�����ȡ���˾�����Ŀ�ijɾͣ����й���ʹ�õIJ��ֲ���������ʾ�����������л��߷��ӵ���
A.  ����Ĵ����Ŷա���������
����Ĵ����Ŷա���������
B.  ������̫�����˾۱�ʵ��װ�á����ٺϽ�
������̫�����˾۱�ʵ��װ�á����ٺϽ�
C.  ���������ػ�֮����϶���𡪡��۰���
���������ػ�֮����϶���𡪡��۰���
D.  �����á�����̫���ܵ�ط��塪����
�����á�����̫���ܵ�ط��塪����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.10 mol/L��NaOH��Һ�ֱ�ζ������Ϊ20.00mL��Ũ�Ⱦ�Ϊ0.050 mol/L�����ᡢ���ἰ�Ȱ���(H2G)���ζ�������ͼ��ʾ��
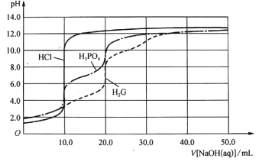
����˵����ȷ����
A.�ζ�����ʱ���ü�����ָʾ�����÷�̪����
B.H3PO4��H2G�ĵ�һ����ƽ�ⳣ��K1����������ͬ
C.�÷�̪��ָʾ���ζ����ᵽ�յ�ʱ����Һ�е�����ΪNa2HPO4
D.NaH2PO4��Һ�У�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ĺϽ��仯������;�dz��㷺���ش��������⣺
(1)��̬Crԭ�Ӻ�����ӵ��Ų�ʽ��[Ar] ___����̬��ԭ����ռ������ܼ��ĵ���������ͼΪ____�Ρ�
(2)������������Ȼ����Ҷ����ϸ�![]() ��������ϸ����{(NH4)3[Cr(C2O4)3]}�ȡ�
��������ϸ����{(NH4)3[Cr(C2O4)3]}�ȡ�
������en��ʾNH2CH2CH2NH2������̼ԭ�ӵ��ӻ���ʽ��____��
��NH4+�ռ乹��Ϊ____��������Ϸ�ʽ��ͬ�ҿռ乹��Ҳ��ͬ�ĺ�����������_____ ��
��C��N��O����Ԫ�ص�һ��������С�����˳��Ϊ ___��![]() ����������Ԫ����������ṹ��_______________��
����������Ԫ����������ṹ��_______________��
(3)����[H3BO3��B(OH)3]Ϊ��ɫƬ״���壬�۵�Ϊ171�档����˵����ȷ����___����ĸ)��
A.��������У���OBO�ļ���Ϊ120�� B.��������д�������������
C.���ᾧ���У�Ƭ���ڴ������ D.���ᾧ���У�Ƭ�����ڹ��ۼ�
(4)2019��11�¡�EurekAlert�������˸��������ﳬ���壬�侧���ṹ��ͼ��ʾ��

������Ԫ��Pr(��)��Cr��N���ɵĸû�����Ļ�ѧʽΪ ___��
(5)CrB2�ľ����ṹ��ͼ��ʾ���������ױ߱߳�Ϊacm����Ϊc cm�������ӵ�������ֵΪNA��CrB2���ܶ�Ϊ ___gcm-3(�г�����ʽ)��
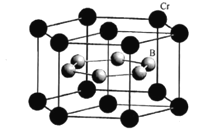
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ʋ���������
A. ������84������Һ
������84������Һ
B.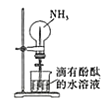 ������Ȫʵ��̽��NH3�IJ�������
������Ȫʵ��̽��NH3�IJ�������
C. �Ʊ�Fe(OH)2��ɫ����
�Ʊ�Fe(OH)2��ɫ����
D.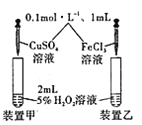 ̽����ͬ������˫��ˮ�ֽ����ʵ�Ӱ��
̽����ͬ������˫��ˮ�ֽ����ʵ�Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ̶������ش��ʵ�ʹ�ô�����������ʳ�������˹��̵�����Ч�ķ����Ǻϳɺ���һ�ֹ�ҵ�ϳɰ��ļ���������ͼ��ʾ(���������ڴ���������δ�г�)��

�ش��������⣺
��.����A��������ԭ��֮һ��CH4(g)+2H2O(g)CO2(g)+4H2(g) H=a kJ/mol
(1)��֪��H2��CH4��ȼ���ȷֱ�Ϊ285.8kJ/mol��890.31k/mol��H2O(g)H2O(l) H=-44kJ/mol��a=____kJ/mol��
(2)���ܱ������У����ܼӿ췴Ӧ���ʣ���һ�������ƽ����ϵ��H2��������Ĵ�ʩ��_____(�����)��
a.������� b.�����¶� c.����ѹǿ d.����c(H2O)
��.����B�����ԭ��������ͨ������C�ϳɰ�����ԭ��ΪN2(g)+3H2(g)![]() 2NH3(g) H=-92.4kJ/mol��
2NH3(g) H=-92.4kJ/mol��
(3)��T���£���һ���ݻ�Ϊ2L������ܱ�������(�д���)ͨ��lmol N2��3mol H2��1���Ӻ�ﵽ��ѧƽ��״̬����������ڵ�ѹǿ�ǿ�ʼʱ��0.8������
������������˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����______(�����)��
a.3v(H2)��=2v(NH3)�� b.��������ƽ����Է����������ٷ����ı�
c.���������ܶȲ��ٷ����ı� d. 1��N��N�����ѵ�ͬʱ��3��H��H������
��t������v(H2)=_______��
��T���¸÷�Ӧ��K=___________(�г�����ʽ����)��
��һ�������£��������ͬ�ļ�(������)�������������зֱ��������ʵ�����N2�͵����ʵ�����H2���кϳɰ���Ӧ������Ӧ1Сʱ�����N2��ת�������¶ȱ仯��ͼ��ʾ��a��b��c�����дﵽ��ѧƽ��״̬�ĵ���_________����װ����N2ת���������¶ȵ�����������ԭ�������______��

(4)�ҹ���ѧ�ҳɹ����Ƴ�һ�ָ�Ч����̵�����Mo2N����̵�ԭ����ͼ��ʾ����װ���У������ϵĵ缫��ӦʽΪ______��
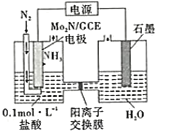
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮ�е��ܽ��Ϊ��0.18g��4�棩��0.34g��25�棩��6.8g��95�棩��ij�����ᾧ�� �к���������������X������������Y������������װ�úͲ��������ᴿ��װ�ã�
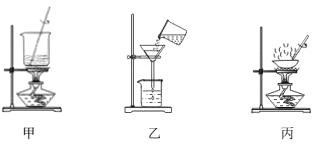
�������ٳ��¹��ˢڳ��ȹ��ˢۼ����ܽ�ܽᾧ��ϴ�ӡ����������й�˵����ȷ����_________
A.�ü�װ���ܽ���Ʒ��X �ڵڢٲ�������
B.����װ�ó��ȹ��ˣ�Y �ڵڢڲ�������
C.�ñ�װ����ʾ�ķ����ᾧ
D.��ȷ�IJ���˳��Ϊ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У�NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
��1��NH4Al(SO4)2������ˮ������������_______________(�ñ�Ҫ�Ļ�ѧ������������˵��)��
��2����ͬ�����£�0.1 mol/L NH4Al(SO4)2�е�c(NH![]() )________(����������������������С����)0.1 mol/L NH4HSO4�е�c(NH
)________(����������������������С����)0.1 mol/L NH4HSO4�е�c(NH![]() )��
)��
��3����ͼ��0.1 mol/L�������Һ��pH���¶ȱ仯��ͼ��

�����з���0.1 mol/L NH4Al(SO4)2��pH���¶ȱ仯��������________(��д��ĸ)������pH���¶ȱ仯��ԭ����___________________��
��20��ʱ��0.1 mol/L NH4Al(SO4)2��2c(SO![]() )��c(NH
)��c(NH![]() )��3c(Al3��)��________��
)��3c(Al3��)��________��
��4������ʱ����100 mL 0.1 mol/L NH4HSO4��Һ�еμ�0.1 mol/L NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��

�Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�������________����b�㣬��Һ�и�����Ũ���ɴ�С������˳����_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com