
【题目】碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)=![]() H2(g)+
H2(g)+![]() I2(aq) ΔH2
I2(aq) ΔH2
反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=___(用ΔH1、ΔH2表示)。
②分析上述反应,下列判断正确的是___
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
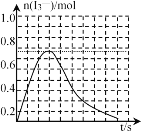
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)![]() I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是___。
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是___。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:___。
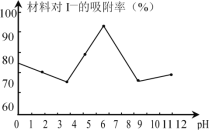
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___(填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)![]() AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=___[用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。该方法去除碘离子的原理是___。
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=___[用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。该方法去除碘离子的原理是___。
【答案】ΔH1+2ΔH2 bc 开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq)![]() I3-(aq)的反应平衡向右移动,n(I3-)不断增加 5Cl2+I2+6H2O=2IO3-+10Cl-+12H+ 中性
I3-(aq)的反应平衡向右移动,n(I3-)不断增加 5Cl2+I2+6H2O=2IO3-+10Cl-+12H+ 中性 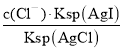 AgI的溶度积比AgCl的溶度积小
AgI的溶度积比AgCl的溶度积小
【解析】
(1)①SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)①△H1;HI(aq)=![]() H2(g)+
H2(g)+![]() I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2,据此进行分析;
I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2,据此进行分析;
②a.反应Ⅲ△S>0、△H>0,如能自发进行,应满足△H﹣T△S<0;
b.氧化还原反应中还原剂的还原性大于还原产物的还原性;
c.分解水制备氢气,应不断补充H2O;
d.循环过程中产生1mol O2同时产生2mol H2;
③开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I﹣(aq)I3﹣(aq)的反应平衡向右移动,n(I3﹣)不断增加;
(2)氯气与碘单质反应生成碘酸根离子和氯离子;
(3)由图象可知pH=7时,吸附效果最好;
(4)Ksp(AgCl)=c(Ag+)c(Cl﹣),则c(Ag+)=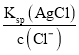 ,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=
,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=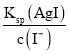 ,故
,故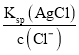 =
=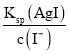 ,且AgI的溶度积比AgCl的溶度积小。
,且AgI的溶度积比AgCl的溶度积小。
(1)①SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)①△H1;HI(aq)=![]() H2(g)+
H2(g)+![]() I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2;
I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2;
②a.反应Ⅲ△S>0、△H>0,在高温下可满足△H﹣T△S<0,故a错误;
b.氧化还原反应中还原剂的还原性大于还原产物的还原性,还原性SO2还原性比HI强,故b正确;
c.分解水制备氢气,应不断补充H2O,故c正确;
d.循环过程中产生1mol O2同时产生2mol H2,故d错误,
故答案为:bc;
③N(I3﹣)逐渐增大的原因是,开始阶段,SO2和I2反应生成的I﹣的浓度不断增大,I2(aq)+I﹣(aq)I3﹣(aq)的反应平衡向右移动,n(I3﹣)不断增加;
(2)氯气过量就能将碘单质进一步氧化成碘酸根离子,故氯气与碘单质反应的离子方程式为5Cl2+I2+7H2O=2IO3﹣+10Cl﹣+12H+;
(3)据图象分析pH=7时,吸附效果最好,故最适合吸附的是中性;
(4) Ksp(AgCl)=c(Ag+)c(Cl﹣),则c(Ag+)=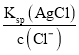 ,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=
,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=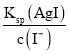 ,故
,故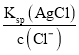 =
=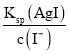 ,,故c(I﹣)=
,,故c(I﹣)=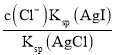 ,该方法去除碘离子的原理是利用AgI的溶度积比AgCl的溶度积小。
,该方法去除碘离子的原理是利用AgI的溶度积比AgCl的溶度积小。


科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A.H2CO3 ![]() 2H+ + CO32-B.NH3·H2O=NH4+ + OH-
2H+ + CO32-B.NH3·H2O=NH4+ + OH-
C.MgCl2 ═ Mg2+ + Cl2-D.NaHSO4 ═ Na+ + H+ + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,物质的量最大的是________,含分子个数最多的是________,含原子个数最多的是________,质量最大的是________。
A.6 g H2;
B.0.5 mol CO2;
C.1.204×1024个HCl分子;
D.标准状况下33.6LCH4;
E.92 g乙醇(C2H5OH);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡被誉为“电子陶瓷工业的支柱”。工业制取方法如图,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)24H2O],煅烧后可获得钛酸钡粉体。
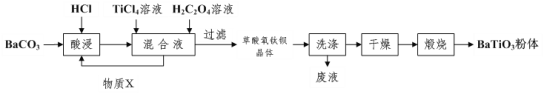
(1)酸浸时发生的反应的离子方程式为___。
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是___。
(3)加入H2C2O4溶液时,发生反应的化学方程式为___。可循环使用的物质X是___(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:___。
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气态产物有CO、___。
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.59×10-9,请问至少需要___molL-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为海水综合利用部分流程,有关说法不正确的是
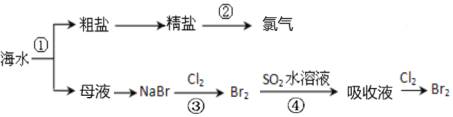
A.上述工艺流程中涉及到化合、分解、复分解和置换反应
B.①只发生物理变化
C.②是工业上电解饱和食盐水制备Cl2
D.③④涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
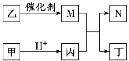
A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不正确的是
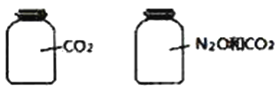
A. 所含氧原子数相等 B. 气体的总质量相等
C. 气体所含电子总数相等 D. 气体的密度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com