
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌНЋ3molAКЭ1molBСНжжЦјЬхЛьКЯгкЙЬЖЈШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌЗЂЩњШчЯТЗДгІЃК3A(g)+B(g)![]() xC(g)+2D(s)ЁЃ2minФЉИУЗДгІДяЕНЦНКтЃЌЩњГЩ0.8molDЃЌВЂВтЕУCЕФХЈЖШЮЊ0.2mol/LЁЃЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
xC(g)+2D(s)ЁЃ2minФЉИУЗДгІДяЕНЦНКтЃЌЩњГЩ0.8molDЃЌВЂВтЕУCЕФХЈЖШЮЊ0.2mol/LЁЃЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
A.ИУЬѕМўЯТДЫЗДгІЕФЛЏбЇЦНКтГЃЪ§дМЮЊ0.91(L/mol)3
B.AЕФЦНОљЗДгІЫйТЪЮЊ0.3mol/(L![]() s)
s)
C.BЕФзЊЛЏТЪЮЊ60%
D.ШєЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЪБЃЌИУЗДгІВЛвЛЖЈДяЕНЦНКтзДЬЌ
ЁОД№АИЁПA
ЁОНтЮіЁП
ИљОнЗНГЬЪНРћгУШ§ЖЮЗЈНјааМЦЫуЁЃ
Ц№ЪМЪБAЕФХЈЖШЪЧ1.5mol/LЃЌBЕФХЈЖШЪЧ0.5mol/LЃЌдђга
3A(g) + B(g) ![]() xC(g) + 2D(s)
xC(g) + 2D(s)
ЪМ(mol/L) 1.5 0.5 0 0
зЊ(mol/L) 0.6 0.2 0.2 0.4
ЦН(mol/L) 0.9 0.3 0.2 0.4
зЊЛЏСПжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌПЩжЊx=1ЃЌЗНГЬЪНЮЊ3A(g)+B(g)![]() xC(g)+2D(s)
xC(g)+2D(s)
A. ЦНКтГЃЪ§K=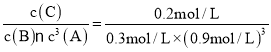 =0.91(L/mol)3ЃЌAЯюе§ШЗЃЛ
=0.91(L/mol)3ЃЌAЯюе§ШЗЃЛ
B.v(A)=![]() =0.3 mol/(L
=0.3 mol/(L![]() min)ЃЌBЯюДэЮѓЃЛ
min)ЃЌBЯюДэЮѓЃЛ
C.BЕФзЊЛЏТЪЮЊ![]() ЁС100%=40%ЃЌCЯюДэЮѓЃЛ
ЁС100%=40%ЃЌCЯюДэЮѓЃЛ
D.ИУЗДгІЮЊЗЧЕШЬхЛ§ЗДгІЃЌШнЦїШнЛ§ЙЬЖЈЃЌЦјЬхЕФзмЬхЛ§ВЛБфЃЌЕЋЦјЬхЕФзмжЪСПИФБфЃЌЕБЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЪБЃЌИУЗДгІвЛЖЈДяЕНЦНКтзДЬЌЃЌDЯюДэЮѓЃЛ
Д№АИбЁAЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЛЏбЇЗНГЬЪНЃК![]() ЁЃдкИУЗДгІжаЃЌЦЦЛЕ1mol EGжаЕФЛЏбЇМќашЮќЪеФмСПQ1ЃЌЦЦЛЕ1mol JLжаЕФЛЏбЇМќашЮќЪеФмСПQ2ЃЌаЮГЩ1mol ELжаЕФЛЏбЇМќашЗХГіФмСПQ3ЃЌаЮГЩ1mol JGжаЕФЛЏбЇМќашЗХГіФмСПQ4ШєИУЗДгІЗХГіФмСПЃЌдђЯТСаЙиЯЕЪНвЛЖЈе§ШЗЕФЪЧЃЈ ЃЉ
ЁЃдкИУЗДгІжаЃЌЦЦЛЕ1mol EGжаЕФЛЏбЇМќашЮќЪеФмСПQ1ЃЌЦЦЛЕ1mol JLжаЕФЛЏбЇМќашЮќЪеФмСПQ2ЃЌаЮГЩ1mol ELжаЕФЛЏбЇМќашЗХГіФмСПQ3ЃЌаЮГЩ1mol JGжаЕФЛЏбЇМќашЗХГіФмСПQ4ШєИУЗДгІЗХГіФмСПЃЌдђЯТСаЙиЯЕЪНвЛЖЈе§ШЗЕФЪЧЃЈ ЃЉ
A.Q1+ Q2> Q3+ Q4B.Q1< Q3+ Q4C.Q2< Q3D.Q2< Q4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊНЈЩшУРРіеуНЃЌеуНЪЁеўИЎПЊеЙЁАЮхЫЎЙВжЮЁБЁЃ
ЃЈ1ЃЉГЧЪавћгУЫЎДІРэЪБПЩгУЖўбѕЛЏТШЃЈClO2ЃЉЬцДњДЋЭГЕФОЛЫЎМСCl2ЁЃЙЄвЕЩЯПЩгУCl2бѕЛЏNaClO2ШмвКжЦШЁClO2ЁЃаДГіИУЗДгІЕФРызгЗНГЬЪНЃЌВЂБъГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЃК_______________ЁЃ
ЃЈ2ЃЉФГЕиЮлЫЎжаЕФгаЛњЮлШОЮяжївЊГЩЗжЪЧШ§ТШввЯЉ ЃЈC2HCl3ЃЉЃЌЯђДЫЮлЫЎжаМгШыKMnO4ЃЈИпУЬЫсМиЕФЛЙдВњЮяЮЊMnO2ЃЉШмвКПЩНЋЦфжаЕФШ§ТШввЯЉГ§ШЅЃЌбѕЛЏВњЮяжЛгаCO2ЃЌаДГіИУЗДгІЕФЛЏбЇЗНГЬЪН_________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњЮяZЪЧвЛжжЬьШЛГ§ВнМСЃЌПЩгЩXЁЂYдквЛЖЈЬѕМўЯТЗДгІжЦЕУЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
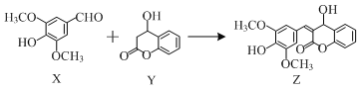
A.гаЛњЮяXзюЖрПЩгы3molH2ЗЂЩњМгГЩЗДгІ
B.ПЩгУFeCl3ШмвКМјБ№XКЭY
C.YдкCuзїДпЛЏМСЬѕМўЯТПЩБЛбѕЛЏЮЊКЌШЉЛљЕФЮяжЪ
D.XгыYжЛЭЈЙ§МгГЩЗДгІМДПЩЩњГЩZ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП![]() ОЇЬхЕФОЇАћНсЙЙгыNaClОЇЬхЕФЯрЫЦ
ОЇЬхЕФОЇАћНсЙЙгыNaClОЇЬхЕФЯрЫЦ![]() ШчЭМЫљЪО
ШчЭМЫљЪО![]() ЃЌЕЋвђЮЊ
ЃЌЕЋвђЮЊ![]() ОЇЬхжаКЌгаЕФбЦСхаЮ
ОЇЬхжаКЌгаЕФбЦСхаЮ![]() ЕФДцдкЃЌЪЙОЇАћбивЛИіЗНЯђРГЄЁЃЯТСаЙигк
ЕФДцдкЃЌЪЙОЇАћбивЛИіЗНЯђРГЄЁЃЯТСаЙигк![]() ОЇЬхЕФЫЕЗЈжае§ШЗЕФЪЧ
ОЇЬхЕФЫЕЗЈжае§ШЗЕФЪЧ![]()

A. 1Иі![]() жмЮЇОрРызюНќЧвЕШОрРыЕФ
жмЮЇОрРызюНќЧвЕШОрРыЕФ![]() Ъ§ФПЮЊ4
Ъ§ФПЮЊ4
B. ИУОЇЬхжаЕФвѕРызгКЭO2ЪЧЕШЕчзгЬх
C. ![]() ПЫ
ПЫ![]() ОЇЬхжаКЌвѕРызг0.2mol
ОЇЬхжаКЌвѕРызг0.2mol
D. гыУПИі![]() ОрРыЯрЕШЧвзюНќЕФ
ОрРыЯрЕШЧвзюНќЕФ![]() ЙВга12Иі
ЙВга12Иі
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввДМЪЧживЊЕФгаЛњЛЏЙЄдСЯЃЌПЩгЩввЯЉжБНгЫЎКЯЗЈЛђМфНгЫЎКЯЗЈЩњВњЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉМфНгЫЎКЯЗЈЪЧжИЯШНЋввЯЉгыХЈСђЫсЗДгІЩњГЩСђЫсЧтввѕЅ(C2H5OSO3H)ЁЃдйЫЎНтЩњГЩввДМЁЃввЯЉЦјЯржБНгЫЎКЯЗДгІC2H4(g)ЃЋH2O(g)ЃНC2H5OH(g)ЕФгыМфНгЫЎКЯЗЈЯрБШЃЌЦјЯржБНгЫЎКЯЗЈЕФгХЕуЪЧЃК___ЁЃ
ЃЈ2ЃЉШчЭМЮЊЦјЯржБНгЫЎКЯЗЈжаввЯЉЕФЦНКтзЊЛЏТЪгыЮТЖШЁЂбЙЧПЕФЙиЯЕ(Цфжаn(H2O)ЉUn(C2H4)=1ЉU1)
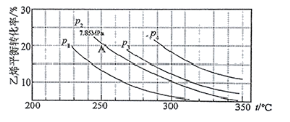
ЂйЭМжабЙЧПP1ЁЂP2ЁЂP3ЁЂP4ЕФДѓаЁЫГађЮЊЃК___ЃЌРэгЩЪЧЃК___ЁЃ
ЂкЦјЯржБНгЫЎКЯЗЈЕГВЩгУЕФЙЄвеЬѕМўЮЊЃКСзЫс/ЙшдхЭСЮЊДпЛЏМСЃЌЗДгІЮТЖШ290ЁцЃЌбЙЧП6.9MPaЃЌn(H2O)ЉUn(C2H4)=0.6ЉU1ЁЃввЯЉЕФзЊЛЏТЪЮЊ5ЈGЁЃШєвЊНјвЛВНЬсИпввЯЉЕФзЊЛЏТЪЃЌГ§СЫПЩвдЪЪЕБИФБфЗДгІЮТЖШКЭбЙЧПЭтЃЌЛЙПЩвдВЩШЁЕФДыЪЉгаЃК___ЁЂ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬНОПВнЫсЃЈH2C2O4ЃЉаджЪЃЌНјааШчЯТЪЕбщЁЃЃЈвбжЊЃКЪвЮТЯТЃЌ0.1 molЁЄL1 H2C2O4ЕФpH=1.3ЃЉ
ЪЕбщ | зАжУ | ЪдМСa | ЯжЯѓ |
Ђй |
| Ca(OH)2ШмвКЃЈКЌЗгЬЊЃЉ | ШмвКЭЪЩЋЃЌВњЩњАзЩЋГСЕэ |
Ђк | ЩйСПNaHCO3ШмвК | ВњЩњЦјХн | |
Ђл | ЫсадKMnO4ШмвК | зЯЩЋШмвКЭЪЩЋ | |
Ђм | C2H5OHКЭХЈСђЫс | МгШШКѓВњЩњгаЯуЮЖЮяжЪ |
гЩЩЯЪіЪЕбщЫљЕУВнЫсаджЪЫљЖдгІЕФЗНГЬЪНВЛе§ШЗЕФЪЧ
A. H2C2O4гаЫсадЃЌCa(OH)2+ H2C2O4![]() CaC2O4Ё§+2H2O
CaC2O4Ё§+2H2O
B. ЫсадЃКH2C2O4> H2CO3ЃЌNaHCO3+ H2C2O4![]() NaHC2O4+CO2Ёќ+H2O
NaHC2O4+CO2Ёќ+H2O
C. H2C2O4ОпгаЛЙдадЃЌ2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2Ёќ+ 8H2O
2Mn2++10CO2Ёќ+ 8H2O
D. H2C2O4ПЩЗЂЩњѕЅЛЏЗДгІЃЌHOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)аДГідкПеЦјжаМгШШNi(OH)2жЦШЁNiOOHЕФЛЏбЇЗНГЬЪНЃК__________________________ЁЃ
(2)H2SШМЩеЩњГЩЕФSO2гыH2SНјвЛВНЗДгІЃЌСђдЊЫизЊЛЏЮЊS2ЃЌаДГіЗДгІЕФЛЏбЇЗНГЬЪНЃК__________________________ЁЃ
(3)дкЫсадЬѕМўЯТЃЌNaHSO3ЪЙCr2O72-ЛЙдГЩЮЊCr3+ЃЌЧыаДГіNaHSO3гыCr2O72-ЗДгІЕФРызгЗНГЬЪНЃК__________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаДыЪЉЖддіДѓЗДгІЫйТЪгааЇЕФЪЧ( )
A.![]() гыЯЁСђЫсЗДгІжЦШЁH2ЪБЃЌИФгУХЈСђЫс
гыЯЁСђЫсЗДгІжЦШЁH2ЪБЃЌИФгУХЈСђЫс
B.NaгыЫЎЗДгІЪБЃЌдіДѓЫЎЕФгУСП
C.дкK2SO4ШмвКгыBaCl2ШмвКЗДгІЪБЃЌдіДѓбЙЧП
D.дкУмБеШнЦїжаНјааЗДгІ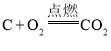 ЪБЃЌбЙЫѕШнЦїЬхЛ§ЃЌдіДѓбЙЧП
ЪБЃЌбЙЫѕШнЦїЬхЛ§ЃЌдіДѓбЙЧП
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com