

A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
科目:高中化学 来源:不详 题型:单选题
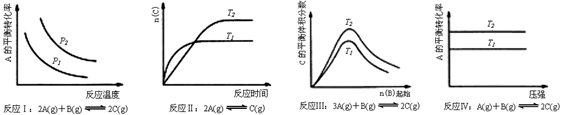
| A.反应Ⅰ:△H>0,p2>p1 |
| B.反应Ⅱ:△H>0,T1>T2 |
| C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 |
| D.反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

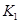 、
、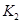 与
与 之间的关系,
之间的关系,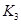 =______用
=______用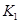 、
、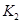 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻, 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。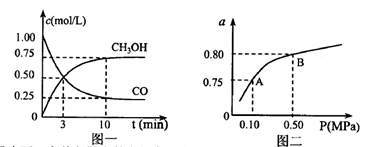
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
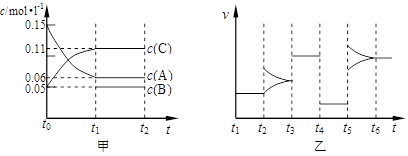
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
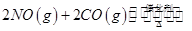
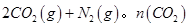 随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题: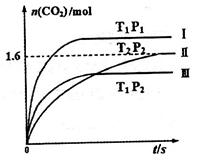
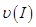 、
、 、
、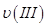 ,则三者大小关系为______________。
,则三者大小关系为______________。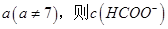 ________
________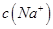 (填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
(填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。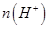 b.
b.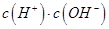 c.
c.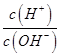 d.
d.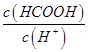
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
| A.增加A的物质的量,正反应速率加快 |
| B.平衡时,其他条件不变,当温度升高时,θ变大 |
| C.图中曲线的斜率表示反应的化学平衡常数 |
| D.平衡时,其他条件不变,再通人B,则反应混合物的温度升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是
qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是| A.通入氦气使密闭容器中压强增大,平衡向正反应方向移动 |
| B.增加X的物质的量,混合气体的密度减小 |
| C.降低温度,混合气体的平均相对分子质量增大 |
| D.X的正反应速率是Y的逆反应速率的m/n倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: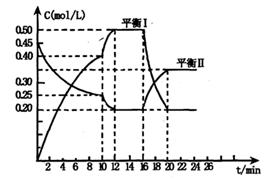
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com