
【题目】根据如图所示实验装置,回答下列问题。
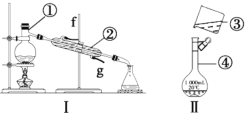
(1)写出下列仪器的名称:①___,④___。
(2)仪器①~④中,使用时必须检查是否漏水的是___(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是___,②的进水口是__(填“f”或“g”)。
(4)配制溶液时,下列操作会导致所配溶液的浓度偏低的是__(填标号)。
a.洗涤烧杯和玻璃棒的溶液未转移入容量瓶中
b.定容时,眼睛俯视使溶液凹面最低点与容量瓶刻度线相切
c.容量瓶中原残留有少量蒸馏水
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
【答案】蒸馏烧瓶 容量瓶 ④ 温度计 g ad
【解析】
(1)根据装置图确定仪器的名称;
(2)容量瓶使用前必须检漏;
(3)装置Ⅰ为蒸馏装置,需要温度计测量蒸气的温度;②为冷凝管,冷凝水的进出水方向为下进上出;
(4)a. 洗涤烧杯和玻璃棒的溶液未转移入容量瓶中,溶质减少;
b. 定容时,眼睛俯视使溶液凹面最低点与容量瓶刻度线相切,溶液的实际体积偏小;
c. 容量瓶中原残留有少量蒸馏水,对溶液的配制没有影响;
d. 定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线,溶质的量减少。
(1)由装置图可知,①为蒸馏烧瓶,④为容量瓶;
(2)容量瓶使用前必须检漏,因此仪器①~④中,使用时必须检查是否漏水的是④;
(3)装置Ⅰ为蒸馏装置,需要温度计测量蒸气的温度,因此;用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是温度计;②为冷凝管,冷凝水的进出水方向为下进上出,因此进水口是g;
(4)a. 洗涤烧杯和玻璃棒的溶液未转移入容量瓶中,溶质减少,导致所配溶液浓度偏低,a项正确;
b. 定容时,眼睛俯视使溶液凹面最低点与容量瓶刻度线相切,溶液的实际体积偏小,导致所配溶液浓度偏高,b项错误;
c. 容量瓶中原残留有少量蒸馏水,对结果没有影响,c项错误;
d. 定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线,溶质的量减少,导致所配溶液浓度偏低,d项正确;
答案选ad。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】(1)蛋白质是生命的基础,是人体必需的_____之一,蛋白质在___的作用下发生水解,水解的最终产物是__。蛋白质的基本组成为氨基酸,其分子中一定含有的官能团是_____和____,他的通式是____。人体中总共有20多种氨基酸,其中有几种是人体_____(填能或不能)合成的氨基酸,称为人体氨基酸。
(2)在盛有鸡蛋白溶液的试管中,加入浓的硫酸铵溶液,可使蛋白质的______降低,而从溶液中析出,这种作用叫做_____。继续加水时,沉淀会_______,并不影响原来蛋白质的性质。
(3)在盛有鸡蛋白溶液的试管中,加入硫酸铜溶液,蛋白质凝结起来,这种作用是___。继续加水时,___恢复为原来的蛋白质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的一些物质或概念之间的从属关系不正确的是( )
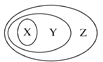
X | Y | Z | |
例 | 氧化物 | 化合物 | 纯净物 |
A | 含氧酸 | 酸 | 化合物 |
B | 溶液 | 分散系 | 混合物 |
C | 强电解质 | 电解质 | 化合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:__。
(2)下列三种情况下,离子方程式与(1)相同的是__(填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至![]() 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
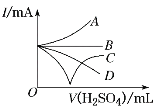
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图中的__曲线表示(填字母)。
(4)化合物高铁酸钾K2FeO4可作为一种“绿色高效多功能”的水处理剂,可由FeCl3和KClO在强碱条件下反应制得,该反应的离子方程式为__(反应物写Fe3+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8kJ·mol-1
B.甲烷的燃烧热为△H=-890kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJmol-1
2NH3(g) △H=-38.6kJmol-1
D.25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,则2H+(aq)+SO![]() (aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
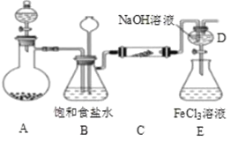
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为__;装置B中饱和食盐水的作用是___;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__。
(2)甲同学为验证氯气是否具有漂白性,在装置C中放入干燥的有色布条,实验中观察到有色布条褪色,能否说明氯气具有漂白性___,说明理由__。
(3)利用D、E装置可制取高效的水处理剂高铁酸钠(Na2FeO4),请写出E中的化学反方程式___。
(4)上述制备氯气并进行相关实验的装置存在明显的缺陷,请指出___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.明矾溶于水产生Al(OH)3胶体,离子方程式可表示为:Al3++3H2O=Al(OH)3↓+3H+
B.![]() 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物![]() ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则
C.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
D.聚氯乙烯塑料制品可用于食品的包装
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,X均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示![]() 部分产物已略去
部分产物已略去![]() 。则A、X不可能是
。则A、X不可能是
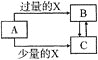
选项 | A | X |
A |
| C |
B |
|
|
C |
| NaOH |
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:

过程I可用如下反应表示:
①2CO2![]() 2CO+O2
2CO+O2
②2H2O![]() 2H2+O2
2H2+O2
③2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
④2CO2+4H2O![]() 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+H2O![]() +3O2
+3O2
请回答下列问题:
(1)过程I的能量转化形式为: 能转化为 能.
(2)请完成第⑤个反应的化学方程式
(3)上述转化过程中,△H1和△H2的关系是
(4)断裂1mol化学键所需的能量见表:
共价键 | H﹣N | H﹣O | N≡N | O=O |
断裂1mol化学键所需能量/kJmol﹣1 | 393 | 460 | 941 | 499 |
常温下,N2和H2O反应生成NH3的热化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com