
【题目】下列说法正确的是
A.明矾溶于水产生Al(OH)3胶体,离子方程式可表示为:Al3++3H2O=Al(OH)3↓+3H+
B.![]() 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物![]() ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则
C.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
D.聚氯乙烯塑料制品可用于食品的包装
科目:高中化学 来源: 题型:
【题目】大气中的含氮化合物主要来源于汽车尾气与工业废气排放。
(1)催化转化器可使汽车尾气中的主要污染物![]() 、
、![]() 进行相互反应,生成无毒物质,减少汽车尾气污染。
进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:![]()
![]()
![]()
![]()
![]()
![]()
计算尾气转化反应![]() 的
的![]() ________。
________。
(2)![]() 催化还原氮氧化物
催化还原氮氧化物![]() 技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:
技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:![]()
![]() 。反应在
。反应在![]() 密闭容器中进行,其它条件相同时,使用不同的催化剂A、B、C,产生
密闭容器中进行,其它条件相同时,使用不同的催化剂A、B、C,产生![]() 的物质的量随时间变化如图1所示。
的物质的量随时间变化如图1所示。
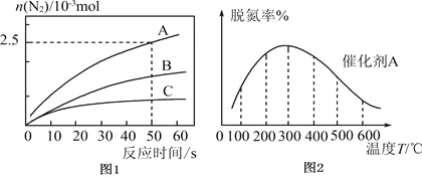
①下列有关说法正确的是___________。
![]() 反应在任何温度下均可自发进行
反应在任何温度下均可自发进行
![]() 在催化剂A作用下,经历
在催化剂A作用下,经历![]() ,平均反应速率
,平均反应速率![]()
![]() 使用催化剂C,达到平衡时,
使用催化剂C,达到平衡时,![]() 产率最小
产率最小
![]() 分离出反应体系中的
分离出反应体系中的![]() 有利于氮氧化物的脱除
有利于氮氧化物的脱除
②实验室在![]() 密闭容器中加入
密闭容器中加入![]() 、
、![]() ,达到平衡时氮氧化物脱氮率为
,达到平衡时氮氧化物脱氮率为![]() ,则平衡常数
,则平衡常数![]() ____________
____________![]() ;
;![]() 只列出计算式,不必求出计算结果
只列出计算式,不必求出计算结果![]()
③在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,![]() 之前,温度升高脱氮率逐渐增大,
之前,温度升高脱氮率逐渐增大,![]() 之后温度升高脱氮率逐渐减小
之后温度升高脱氮率逐渐减小![]() 假设催化剂活性不受影响
假设催化剂活性不受影响![]() ,写出脱氮率随温度变化的原因_________________。
,写出脱氮率随温度变化的原因_________________。
(3)以连二硫酸根![]() 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
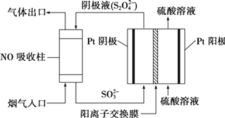
①阴极区的电极反应式为_________________;
②通电,当电路中转移![]() 电子时,可吸收的NO在标准状况下的体积为
电子时,可吸收的NO在标准状况下的体积为![]() 。则NO转化后的产物的化合价为_________________。
。则NO转化后的产物的化合价为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol·L-1MgCl2溶液中c(Cl-)为___mol·L-1,从100mL该溶液中取出20mL再稀释至100mL,c(MgCl2)为__mol·L-1。
(2)将SO2通入氯化钡溶液中无现象;若将SO2通入硝酸钡溶液中有白色沉淀产生,其化学反应方程式如下(未配平):SO2+Ba(NO3)2+H2O→BaSO4↓+HNO3+NO↑。
①配平上述化学反应方程式并用双线桥表示电子转移的方向和数目___。
②该反应中,__元素发生氧化反应,氧化剂是__(写化学式)。氧化产物与还原产物的物质的量之比为___。
③当反应消耗19.2gSO2时,反应中转移电子__mol,在标准状况下,生成NO的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示实验装置,回答下列问题。
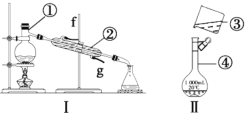
(1)写出下列仪器的名称:①___,④___。
(2)仪器①~④中,使用时必须检查是否漏水的是___(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是___,②的进水口是__(填“f”或“g”)。
(4)配制溶液时,下列操作会导致所配溶液的浓度偏低的是__(填标号)。
a.洗涤烧杯和玻璃棒的溶液未转移入容量瓶中
b.定容时,眼睛俯视使溶液凹面最低点与容量瓶刻度线相切
c.容量瓶中原残留有少量蒸馏水
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如图所示。下列说法正确的是( )
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如图所示。下列说法正确的是( )
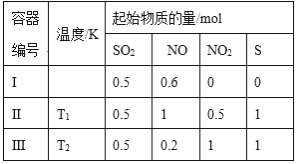
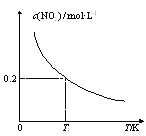
A.该反应的ΔH>0
B.T1时,该反应的平衡常数为![]()
C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比大于1:2
D.若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(s) ΔH>0,若0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(s) ΔH>0,若0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A.0~15s内用I2的平均反应速率为v(I2)=0.001mol·L-1·s-1
B.c(HI)由0.07mol·L-1降到0.05mol·L-1所需的反应时间为小于10s
C.升高温度正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是( )
| 实验目的 | 实验过程 |
A. | 制取并纯化氨气 | 向浓氨水中加入生石灰,将产生的气体通过盛有 |
B. | 探究 | 向 |
C. | 比较 | 向 |
D. | 探究浓度对化学反应速率的影响 | 其他条件一定,向2支均盛有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。请回答下列问题:
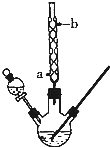
(1)水从冷凝管![]() __(填“a”或“b”)处进入。
__(填“a”或“b”)处进入。
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | ﹣ |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
又知温度高于140℃时发生副反应:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O,该副反应属于___反应(填字母)。
CH3CH2OCH2CH3+H2O,该副反应属于___反应(填字母)。
a.加成 b.取代 c.酯化 d.氧化
(3)将反应后的混合液缓缓倒入盛有足量饱和碳酸钠溶液的烧杯中,搅拌、静置。上述实验中饱和碳酸钠溶液的作用是(填字母):__。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(4)上述(3)中欲分离出乙酸乙酯,应使用的分离方法是__(填操作方法名称,下同),进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用__的方法。
(5)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是__。
(6)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
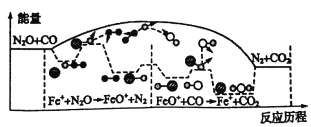
A. 反应总过程△H<0
B. Fe+使反应的活化能减小
C. 总反应若在2L的密闭容器中进行,温度越高反应速率一定越快
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热及应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com